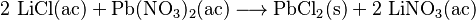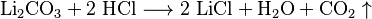Cloruro de litio para niños
Datos para niños
Cloruro de litio |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Cloruro de litio | ||
| General | ||
| Fórmula molecular | LiCl | |
| Identificadores | ||
| Número CAS | 7447-41-8 | |
| ChEBI | CHEBI:48607 | |
| ChEMBL | CHEMBL69710 | |
| ChemSpider | 22449 | |
| PubChem | 433294 | |
| UNII | G4962QA067 | |
|
[Li+].[Cl-]
|
||
|
InChI
InChI=InChI=1S/ClH.Li/h1H;/q;+1/p-1
Key: KWGKDLIKAYFUFQ-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Apariencia | blanco cristalino | |
| Densidad | 2068 kg/m³; 2,068 g/cm³ | |
| Masa molar | 42,39 g/mol | |
| Punto de fusión | 610 °C (883 K) | |
| Punto de ebullición | 1382 °C (1655 K) | |
| Índice de refracción (nD) | 1,662 | |
| Propiedades químicas | ||
| Solubilidad en agua | 68,29 g/100 mL (0 °C) 74,48 g/100 mL (10 °C) 84,25 g/100 mL (25 °C) 88,7 g/100 mL (40 °C) 123,44 g/100 mL (100 °C) |
|
| Momento dipolar | 7,13 D D | |
| Peligrosidad | ||
| SGA |   |
|
| Frases H | H302 H312 H315 H319 H335 | |
| Frases P | P201 P202 P261 P264 P270 P271 P280 P281 P301+P312 P302+P352 P304+P340 P305+P351+P338 P308+P313 P321 P322 P330 P332+P313 P337+P313 P362 P403+P233 P405 P501 | |
| Compuestos relacionados | ||
| Cloruros | Cloruro potásico (KCl), Cloruro sódico (NaCl), Cloruro de rubidio (RbCl), Cloruro de cesio (CsCl) | |
| Halogenuros | Fluoruro de litio (LiF), Bromuro de litio (LiBr), Yoduro de litio (LiI) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
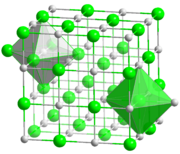
El cloruro de litio es una sal con la fórmula química LiCl. Está formada por los elementos cloro y litio en una proporción de uno a uno. Se parece mucho a la sal común (cloruro de sodio), pero el ion de litio (Li+) es mucho más pequeño.
Este compuesto inorgánico es muy bueno para absorber agua, lo que significa que es muy higroscópico (atrae y retiene la humedad). Por eso, se usa como un excelente secante. También se disuelve mejor en algunos líquidos orgánicos, como el metanol y la acetona, que la sal común o el cloruro de potasio.
Contenido
Propiedades químicas del cloruro de litio
El cloruro de litio puede liberar iones de cloruro. Al igual que otras sales de cloruro que se disuelven en agua, forma un precipitado (una sustancia sólida que se separa de la solución) cuando se añade a una solución de otra sal metálica.
Por ejemplo, si se mezcla cloruro de litio con nitrato de plomo (II), se forma un precipitado de cloruro de plomo:
Otro ejemplo es cuando reacciona con nitrato de plata, formando un precipitado de cloruro de plata:
El ion Li+ puede actuar como un ácido de Lewis débil en ciertas situaciones. Esto significa que puede aceptar pares de electrones. Por ejemplo, una cantidad de cloruro de litio puede absorber más de cuatro veces su cantidad de amoníaco.
A diferencia de otros cloruros de metales alcalinos, el cloruro de litio forma cristales que contienen moléculas de agua, llamados hidratos. Se conocen hidratos con una, tres o cinco moléculas de agua. Para obtener la sal sin agua (anhidra), solo hay que calentar estos hidratos.
¿Cómo se obtiene el cloruro de litio?
El cloruro de litio se puede producir de varias maneras. Una forma es hacer reaccionar una solución de hidróxido de litio o carbonato de litio con ácido clorhídrico.
También se puede obtener mediante una reacción muy energética entre el litio metálico y el cloro o el cloruro de hidrógeno en estado gaseoso.
Hoy en día, la forma más común de obtenerlo es haciendo reaccionar carbonato de litio con ácido clorhídrico. Después, se concentra la solución y se obtiene el cloruro de litio por cristalización en evaporadores especiales.
Las reacciones son:
Además, el cloruro de litio a menudo se produce como un subproducto en la fabricación de compuestos orgánicos que contienen metales.
Si la sal se obtiene en un medio acuoso (con agua), siempre se forma un compuesto cristalino que contiene agua. Para obtener la sal sin agua, se puede hacer reaccionar el hidrato con cloruro de tionilo, liberando dióxido de azufre y ácido clorhídrico.
- <chem>LiCl * H2O + SOCl2 -> LiCl + SO2 + 2 HCl</chem>
Usos del cloruro de litio
El cloruro de litio se usa principalmente para producir litio metálico. Esto se hace mediante un proceso llamado electrólisis, donde se funde una mezcla de cloruro de litio y cloruro de potasio a 450 °C.
También se utiliza como un material que ayuda a fundir en las soldaduras de aluminio, especialmente en la fabricación de automóviles.
Como es un buen secante, se usa para eliminar la humedad de las corrientes de aire. En usos más específicos, el cloruro de litio se emplea en la síntesis orgánica (creación de compuestos orgánicos), por ejemplo, como un aditivo en la reacción de Stille.
En el campo de la bioquímica, puede usarse para separar el ARN de las células.
Además, tiene usos más comunes, como en la fabricación de fuegos pirotécnicos, ya que ayuda a producir llamas de color rojo oscuro.
El cloruro de litio fundido también se usa para crear materiales avanzados como nanotubos de carbono, grafeno y niobato de litio.
Precauciones con el cloruro de litio
Las sales de litio pueden afectar el cuerpo de diversas maneras. Aunque algunas sales de litio se usan en medicina, el cloruro de litio es diferente.
En la década de 1940, por un corto tiempo, el cloruro de litio se vendió como un sustituto de la sal de mesa. Sin embargo, esta práctica se prohibió rápidamente porque se descubrió que el compuesto era tóxico y causaba efectos dañinos en la salud. Por lo tanto, es muy importante manejarlo con cuidado y nunca ingerirlo.
Véase también
 En inglés: Lithium chloride Facts for Kids
En inglés: Lithium chloride Facts for Kids