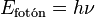Espectro de emisión para niños
El espectro de emisión de un elemento químico o compuesto es como su huella dactilar de luz. Es el conjunto de colores o frecuencias de luz que un átomo o molécula emite cuando sus partículas internas, llamadas electrones, pasan de un estado de alta energía a uno de menor energía.
La energía de la luz emitida (un paquete de energía llamado fotón) es exactamente igual a la diferencia de energía entre esos dos estados. Como cada átomo tiene muchas formas posibles en que sus electrones pueden cambiar de energía, cada cambio produce una luz con una longitud de onda específica. Todas estas luces juntas forman el espectro de emisión.
Lo más interesante es que el espectro de emisión de cada elemento es único. Por eso, los científicos usan una técnica llamada espectroscopia para identificar los elementos presentes en una sustancia desconocida, ¡simplemente analizando la luz que emite!
Contenido
¿Qué es la Emisión de Luz?
En física, la emisión es el proceso por el cual una partícula, como un electrón, pasa de un nivel de energía más alto a uno más bajo, liberando esa energía extra en forma de un fotón, que es una partícula de luz. La frecuencia de la luz emitida depende de la cantidad de energía que se libera en esa transición.
La energía siempre se conserva, así que la diferencia de energía entre los dos niveles del electrón es la misma que la energía que se lleva el fotón. Estas transiciones de energía pueden producir luz en un rango muy amplio de frecuencias. Por ejemplo:
- La luz visible (la que podemos ver) se emite cuando los electrones cambian de nivel en átomos y moléculas. A esto se le llama fluorescencia o fosforescencia.
- Las transiciones en el núcleo de los átomos pueden emitir rayos gamma, que tienen mucha energía.
- Las transiciones de giro de los núcleos pueden emitir ondas de radio, que tienen poca energía.
La cantidad de luz que un objeto emite se llama emitancia. Esta cantidad puede variar con la temperatura y la composición del objeto, lo que nos ayuda a entender su "temperatura de color" y las "líneas de emisión" que vemos. Medir con precisión la luz en muchas longitudes de onda permite identificar una sustancia usando la espectroscopia de emisión.
¿Cómo se Originan los Espectros de Emisión?
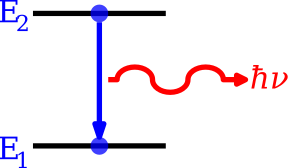
Cuando los electrones en un átomo reciben energía extra, por ejemplo, al calentarse, se "excitan" y saltan a niveles de energía más altos. Pero no se quedan allí para siempre. Cuando estos electrones regresan a sus niveles de energía originales (más bajos), liberan esa energía extra en forma de fotones (partículas de luz).
La longitud de onda (o la frecuencia) del fotón emitido está determinada por la diferencia de energía entre el nivel alto y el nivel bajo. Estos fotones emitidos son los que forman el espectro del elemento.
El hecho de que solo aparezcan ciertos colores en el espectro de emisión de un elemento significa que solo se emiten ciertas frecuencias de luz. Cada una de estas frecuencias está relacionada con la energía por una fórmula muy importante:
Donde 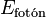 es la energía del fotón,
es la energía del fotón, 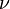 es su frecuencia, y
es su frecuencia, y 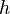 es la constante de Planck. Esto nos dice que los átomos solo emiten fotones con energías muy específicas. Este principio explica por qué los letreros de neón tienen colores tan variados y por qué las pruebas de llama químicas producen colores distintos.
es la constante de Planck. Esto nos dice que los átomos solo emiten fotones con energías muy específicas. Este principio explica por qué los letreros de neón tienen colores tan variados y por qué las pruebas de llama químicas producen colores distintos.
Las frecuencias de luz que un átomo puede emitir dependen de los niveles de energía en los que se encuentran sus electrones. Cuando un electrón se excita, sube a un nivel de energía superior. Cuando regresa a su nivel normal, emite luz.
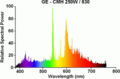
La imagen de arriba muestra el espectro de emisión de luz visible para el hidrógeno. Si solo tuviéramos un átomo de hidrógeno, veríamos solo una longitud de onda en un momento dado. Pero como una muestra contiene muchos átomos de hidrógeno en diferentes estados de energía, vemos varias emisiones posibles al mismo tiempo.
Luz Emitida por Moléculas
Además de los cambios electrónicos, las moléculas también pueden cambiar su energía a través de movimientos de rotación, vibración o una combinación de ambos. Estos cambios de energía a menudo producen grupos de muchas líneas de luz muy juntas, que se conocen como bandas espectrales. A veces, estas bandas pueden parecer una luz continua.
Espectroscopia de Emisión: Una Herramienta de Identificación
La luz está compuesta por radiación electromagnética de diferentes longitudes de onda. Cuando los elementos o sus compuestos se calientan en una llama o con electricidad, emiten energía en forma de luz. Al analizar esta luz con un espectroscopio, obtenemos un espectro que no es continuo, sino que muestra líneas separadas.
Un espectroscopio es un instrumento que separa los componentes de la luz según sus diferentes longitudes de onda. El espectro aparece como una serie de líneas, y a esto se le llama espectro de líneas. Si estas líneas provienen de un átomo en su forma elemental, se le llama espectro atómico. Cada elemento tiene un espectro atómico diferente.
La aparición de estas líneas en el espectro de un elemento nos indica que un átomo solo puede emitir ciertas cantidades de energía. Esto significa que los electrones en un átomo no pueden tener cualquier cantidad de energía, sino solo cantidades muy específicas.
El espectro de emisión es muy útil para determinar de qué está hecho un material, ya que es único para cada elemento de la tabla periódica. Un ejemplo famoso es la espectroscopia astronómica, que permite a los científicos identificar la composición de las estrellas analizando la luz que nos llega de ellas.
Algunas características del espectro de emisión de ciertos elementos son fáciles de ver a simple vista cuando se calientan. Por ejemplo, si sumerges un alambre de platino en una solución de nitrato de estroncio y lo pones en una llama, los átomos de estroncio emitirán una luz roja brillante. De manera similar, el cobre en una llama produce un color verde. Estas características distintivas permiten identificar elementos por su espectro de emisión atómica.
No toda la luz emitida es visible para el ojo humano; el espectro también incluye rayos ultravioleta y radiación infrarroja. Una emisión se forma cuando un gas excitado se observa directamente a través de un espectroscopio.
La espectroscopia de emisión es una técnica que examina las longitudes de onda de los fotones que los átomos o moléculas emiten cuando pasan de un estado de alta energía a uno de menor energía. Cada elemento emite un conjunto característico de longitudes de onda específicas según su estructura electrónica. Al observar estas longitudes de onda, se puede determinar de qué elementos está hecha una muestra. La espectroscopia de emisión se desarrolló a finales del siglo XIX, y los intentos de explicar teóricamente los espectros de emisión atómica llevaron al desarrollo de la mecánica cuántica.
Hay muchas maneras de hacer que los átomos se exciten. Una forma es interactuar con radiación electromagnética, como se usa en la espectroscopia de fluorescencia. Otra forma es calentar la muestra a una temperatura alta, lo que hace que los átomos choquen entre sí y se exciten. Este método se usa en la espectroscopia de emisión de llama, y fue el método que usó Anders Jonas Ångström cuando descubrió las líneas de emisión discretas en la década de 1850.
Aunque las líneas de emisión son causadas por transiciones entre estados de energía específicos y pueden parecer muy nítidas, en realidad tienen un ancho finito, lo que significa que están compuestas por más de una longitud de onda de luz. Este "ensanchamiento de líneas espectrales" tiene varias causas.
La espectroscopia de emisión a menudo se llama espectroscopia de emisión óptica porque se refiere a la luz visible que se emite.
Historia de la Espectroscopia de Emisión
Las líneas de emisión de gases calientes fueron descubiertas por primera vez por Anders Jonas Ångström. La técnica fue desarrollada más a fondo por David Alter, Gustav Kirchhoff y Robert Bunsen.
Técnica Experimental en Espectroscopia de Emisión de Llama
Para realizar una espectroscopia de emisión de llama, la sustancia que se va a analizar se disuelve y se introduce en un quemador, donde se dispersa en la llama como un rocío muy fino. Primero, el líquido se evapora, dejando partículas sólidas diminutas que se mueven a la parte más caliente de la llama. Allí, se forman átomos e iones gaseosos, y sus electrones se excitan como se explicó antes. A menudo se usa un monocromador para facilitar la detección de las diferentes longitudes de onda.
De forma más sencilla, la espectroscopia de emisión de llama se puede observar usando solo una llama y muestras de sales metálicas. Este método de análisis cualitativo se conoce como prueba de llama. Por ejemplo, las sales de sodio en una llama brillan de color amarillo debido a los iones de sodio, mientras que los iones de estroncio (usados en algunas luces de emergencia) la tiñen de rojo. Un alambre de cobre creará una llama azul, pero si hay cloruro presente, la llama se volverá verde (debido a la formación de CuCl).
Coeficiente de Emisión
El coeficiente de emisión es un valor que se usa en física para describir la cantidad de energía de luz que una fuente electromagnética emite por unidad de tiempo. El coeficiente de emisión de un gas cambia con la longitud de onda de la luz. También se usa para medir las emisiones al medio ambiente (en masa) por cada unidad de electricidad generada.
Dispersión de la Luz
En la dispersión de Thomson, una partícula con carga eléctrica emite radiación cuando la luz incide sobre ella. Esta partícula puede ser un electrón atómico común, por lo que los coeficientes de emisión tienen aplicaciones prácticas.
Si X dV dΩ dλ es la energía dispersada por un pequeño volumen dV en un ángulo sólido dΩ entre las longitudes de onda λ y λ + dλ por unidad de tiempo, entonces el coeficiente de emisión es X.
Los valores de X en la dispersión de Thomson se pueden predecir a partir del flujo de luz incidente, la densidad de las partículas cargadas y su sección transversal de Thomson.
Emisión Espontánea
Un cuerpo caliente que emite fotones tiene un coeficiente de emisión relacionado con su temperatura y la radiación total que emite. A esto a veces se le llama el segundo coeficiente de Einstein y se puede deducir de la teoría de la mecánica cuántica.
Véase también
 En inglés: Emission spectrum Facts for Kids
En inglés: Emission spectrum Facts for Kids
- Espectroscopia de absorción
- Línea espectral atómica
- Espectroscopia electromagnética
- Líneas de Fraunhofer
- Lámpara de descarga
- Cambio isomérico
- Cambio isotópico
- Coeficiente luminoso
- Fórmula de Rydberg
- Línea espectral
- Teoría espectral
- La ecuación de diodo incluye el coeficiente de emisión.
- Emisión termoiónica
Galería de imágenes