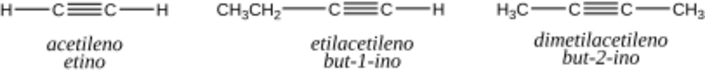Alquino para niños
Los alquinos son un tipo de hidrocarburos, que son compuestos formados solo por carbono e hidrógeno. Lo que los hace especiales es que tienen al menos un triple enlace entre dos átomos de carbono. Imagina que los átomos de carbono están unidos por tres "manos" en lugar de una o dos.
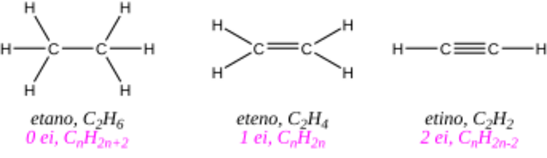
El alquino más sencillo se llama etino, pero es más conocido como acetileno. Su fórmula general es CnH2n-2, lo que significa que tienen menos átomos de hidrógeno que otros hidrocarburos con el mismo número de carbonos.
Los alquinos no se mezclan bien con el agua, pero sí con otros líquidos orgánicos.
Ejemplos de alquinos:
- CH≡CH (etino o acetileno)
- CH3–C≡CH (propino)
- CH3–CH2–C≡CH (1-butino)
- CH3-C≡C-CH3 (2-butino)
- CH≡C- (etinilo)
- CH≡C-CH2– (2-propinilo)
- CH3–C≡C- (1-propinilo)
- CH3–CH2–CH2–C≡CH (1-pentino)
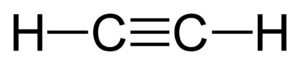
Contenido
¿Qué características tienen los Alquinos?
Los alquinos son similares a los alquenos en cómo reaccionan, especialmente en las reacciones donde se añaden otras sustancias o se oxidan. Sin embargo, los alquinos también tienen reacciones únicas debido a su triple enlace.
El triple enlace hace que un alquino tenga cuatro átomos de hidrógeno menos que un alcano (un hidrocarburo con solo enlaces simples) con el mismo número de carbonos.
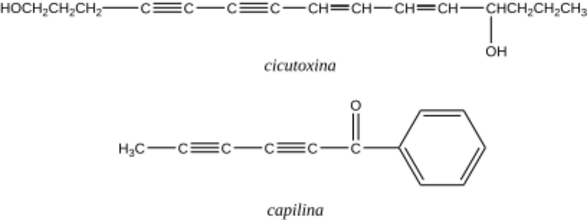
Los alquinos no son tan comunes en la naturaleza como los alquenos. Sin embargo, algunas plantas los usan para protegerse de enfermedades o de animales que quieren comérselas. Por ejemplo, la cicutoxina es una sustancia tóxica que se encuentra en la cicuta acuática. También, la capilina ayuda a las plantas a defenderse de hongos. Algunos alquinos también están presentes en ciertos medicamentos.
¿Qué son los Cicloalquinos?
Los cicloalquinos son alquinos que tienen uno o más triples enlaces dentro de una estructura en forma de anillo. Para nombrarlos, se da prioridad a los triples enlaces al numerar los carbonos del anillo. Luego, se asignan los números más bajos a los grupos que están unidos al anillo y, finalmente, se consideran en orden alfabético.
¿Cómo se nombran los Alquinos?
Existen diferentes formas de nombrar los alquinos para que los científicos puedan identificarlos fácilmente.
Nomenclatura IUPAC
La nomenclatura IUPAC es un sistema de reglas internacional para nombrar compuestos químicos. Para los alquinos, estas son las reglas principales:
- Se elige la cadena de carbonos más larga que contenga el mayor número de triples enlaces.
- Se empieza a numerar la cadena desde el extremo más cercano a un triple enlace.
- Se identifican los grupos que están unidos a la cadena principal y se les da un nombre.
- Estos grupos se nombran en orden alfabético, indicando su posición con números.
- Al final del nombre, se indica la posición de los triples enlaces y se añade el prefijo "di", "tri", "tetra", etc., si hay más de uno, seguido de la terminación "ino".
Cadenas Laterales con Alquinos
Los alquinos también pueden ser parte de grupos que se unen a una cadena principal más grande. En este caso, se nombran como "radicales" usando la raíz del nombre del alquino y la terminación "inil". También se indica la posición del triple enlace.
Cuando un triple enlace no es la parte más importante de un compuesto, se puede indicar su posición y la palabra "ino" dentro del nombre.
Nomenclatura Derivada (Nombres Comunes)
En este sistema, los alquinos se nombran como si fueran derivados del acetileno (etino).
- Se identifica el grupo acetileno que servirá de base para el nombre.
- Se nombran los grupos unidos al acetileno en orden alfabético.
- El nombre termina con la palabra "acetileno" o "etino".
Este método no se usa para alquinos muy complejos.
Casos Especiales: Dobles y Triples Enlaces
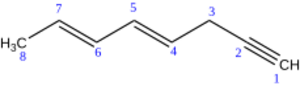
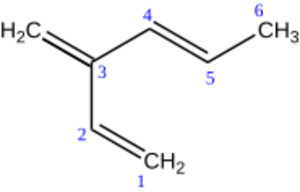
Si un hidrocarburo tiene tanto dobles como triples enlaces, se elige la cadena principal que contenga la mayor cantidad de ambos y el mayor número de carbonos. La numeración comienza por el extremo más cercano a cualquier enlace múltiple. Si están a la misma distancia de ambos extremos, se da prioridad a los dobles enlaces con números más bajos.
La terminación del nombre indicará el número de dobles y triples enlaces, por ejemplo: "en-ino" (un doble y un triple), "dien-ino" (dos dobles y un triple), etc.
¿Qué propiedades físicas tienen los Alquinos?
Los alquinos tienen varias propiedades físicas interesantes:
- No se disuelven en agua, pero sí en líquidos orgánicos como el éter o el benceno.
- Son menos densos que el agua.
- Sus puntos de ebullición (la temperatura a la que hierven) aumentan a medida que tienen más átomos de carbono.
- Los tres alquinos más pequeños son gases a temperatura ambiente; los demás son líquidos o sólidos.
- A medida que su peso molecular aumenta, también lo hacen su densidad, su punto de fusión (la temperatura a la que se derriten) y su punto de ebullición.
- Son compuestos de baja polaridad, por lo que sus propiedades físicas son muy parecidas a las de los alcanos y alquenos.
- Son inflamables, lo que significa que pueden quemarse.
| Propiedades físicas de alquinos seleccionados | ||||
|---|---|---|---|---|
| Nombre | Estructura | pf (°C) | pe (°C) | Densidad (g/cm3) |
| etino (acetileno) | H−C≡C−H | |||
| 0.62 | ||||
| propino | H−C≡C−CH3 | |||
| 0.67 | ||||
| but-1-ino | H−C≡C−CH2CH3 | |||
| 8 | 0.67 | |||
| but-2-ino | CH3−C≡C−CH3 | |||
| 27 | 0.69 | |||
| pent-1-ino | H−C≡C−CH2CH2CH3 | |||
| 40 | 0.70 | |||
| pent-2-ino | CH3−C≡C−CH2CH3 | |||
| 55 | 0.71 | |||
| 3-metilbut-1-ino | CH3−CH(CH3)−C≡C−H | 28 | 0.67 | |
| hex-1-ino | H−C≡C−(CH2)3−CH3 | |||
| 71 | 0.72 | |||
| hex-2-ino | CH3−C≡C−CH2CH2CH3 | |||
| 84 | 0.73 | |||
| hex-3-ino | CH3CH2−C≡C−CH2CH3 | |||
| 82 | 0.73 | |||
| 3,3-dimetilbut-1-ino | (CH3)3C−C≡C−H | |||
| 38 | 0.67 | |||
| hept-1-ino | H−C≡C−(CH2)4CH3 | |||
| 100 | 0.73 | |||
| oct-1-ino | H−C≡C−(CH2)5CH3 | |||
| 125 | 0.75 | |||
| non-1-ino | H−C≡C−(CH2)6CH3 | |||
| 151 | 0.76 | |||
| dec-1-ino | H−C≡C−(CH2)7CH3 | |||
| 174 | 0.77 | |||
¿Qué propiedades químicas tienen los Alquinos?
Las reacciones más comunes de los alquinos son las de adición. En estas reacciones, el triple enlace se rompe y se forman enlaces dobles o simples.
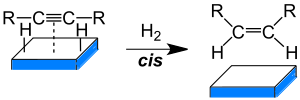
Hidrogenación de Alquinos
Los alquinos pueden reaccionar con hidrógeno para formar alquenos (con un doble enlace) o alcanos (con solo enlaces simples). Esto se hace usando un catalizador, que es una sustancia que acelera la reacción sin consumirse. Por ejemplo, si se usa un catalizador especial llamado catalizador de Lindlar, se forma un alqueno. Si se usa otro catalizador, como paladio sobre carbón, la reacción continúa hasta formar un alcano.
- CH≡CH + H2 → CH2=CH2 + H2 → CH3-CH3
Los alquinos también pueden reaccionar con sodio o litio en amoníaco líquido para producir alquenos de tipo trans.
- CH3-C≡C-CH3 + 2 Na + 2 NH3 → CH3-CH=CH-CH3 (trans) + 2 NaNHH2
Reacciones de Adición con Halógenos y Agua
Al igual que los alquenos, los alquinos pueden participar en otras reacciones de adición:
Halógenos
Dependiendo de las condiciones y la cantidad de halógeno (como cloro o bromo) que se añada, se pueden obtener compuestos con halógenos en el doble o en el simple enlace.
- HC≡CH + Br2 → HCBr≡CHBr
- HC≡CH + 2 Br2 → HCBr2-CHBr2
Hidrohalogenación y Hidratación
El triple enlace también puede reaccionar con halogenuros de hidrógeno (como HCl), agua o alcohol. Esto forma enlaces dobles o simples. Generalmente, estas reacciones siguen una regla llamada regla de Markovnikov.
- HC≡CH + H-X → CH2=CHX donde X = F, Cl, Br...
- HC≡CH + H2O → CHOH=CH2
Acidez del Hidrógeno Terminal
En algunas reacciones, los alquinos con un hidrógeno en el extremo (hidrógeno terminal) pueden actuar como ácidos débiles. Esto significa que pueden perder ese hidrógeno. Cuando esto sucede, se forman unas sustancias llamadas acetiluros, que son muy útiles para crear alquinos con cadenas más largas.
- HC≡CH + Na-NH2 → HC≡C:- Na+
- HC≡C:- Na+ + Br-CH3 → HC≡C-CH3 + NaBr
En este ejemplo, el acetiluro de sodio reacciona con bromometano para formar propino.
¿Para qué se usan los Alquinos?
El acetileno (etino) es el alquino más utilizado.
- En la industria química, los alquinos son importantes para fabricar productos como el PVC (un tipo de plástico) y el caucho artificial.
- El grupo alquino está presente en algunos medicamentos.
- Los polímeros hechos de alquinos, llamados polialquinos, pueden ser semiconductores orgánicos, lo que significa que pueden conducir electricidad de manera similar al silicio, pero son flexibles.
- El acetileno se usa para fabricar ácido acético y otros hidrocarburos que se pueden convertir en plásticos y caucho.
- También se usa para soldar metales, como sillas o mesas.
- En casa, algunos solventes orgánicos que contienen alquinos se usan para limpieza en seco, como diluyentes de pintura o para quitar manchas.
- En oficinas, se usan como limpiadores de máquinas y superficies.
- En lavanderías, como líquidos para limpieza en seco.
- En granjas, como pesticidas.
- En laboratorios, como reactivos químicos, agentes secantes y líquidos para extracción.
Usos Específicos de Alquinos
- Acetileno o Etino
El etino, también conocido como acetileno, es un gas muy útil. Cuando se quema con oxígeno puro, produce una llama muy caliente (2,800 grados Celsius) que se usa en soldaduras. También es una materia prima para obtener metilacetileno, que se usa en sopletes porque no se descompone tan fácilmente como el acetileno y puede alcanzar temperaturas más altas.
Sus usos generales son:
- Fabricación de ácido acético.
- Equipos de soldadura.
- Fabricación de caucho sintético y etanal.
- Producción de cloro etileno para plásticos.
- Butino
El butino es un gas alquino muy reactivo e inflamable a temperatura ambiente. Se usa para crear muchos compuestos orgánicos sintéticos. Sus principales usos incluyen:
- Producción de plásticos.
- Producción de compuestos sintéticos orgánicos.
- Uso en la industria para elaborar caucho.
- Propino
Este alquino se usa en soldaduras. Es un gas sin color con un olor particular, más denso que el aire. Si se calienta mucho, se descompone, y si se le aplica presión, puede producir dióxido de carbono y monóxido de carbono, lo que puede causar peligro de explosión o incendio.
- Hexino
Este alquino es de cadena abierta y tiene un estado semilíquido. Se usa principalmente en soldadura autógena. Tiene un triple enlace carbono-carbono.
- Pentino
El pentino es otro alquino. Sus principales aplicaciones son:
- Caucho sintético.
- Corte de metales.
- Soldadura.
¿Qué riesgos tienen los Alquinos?
Impacto en el Ambiente
Los alquinos pueden dañar los ecosistemas marinos porque se encuentran en el petróleo. Cuando hay derrames de petróleo en el mar, ya sean accidentales o intencionales, o cuando la gasolina de las ciudades llega al océano a través de ríos, los alquinos presentes en ellos afectan a los animales marinos. El petróleo puede cubrir su piel y branquias, lo que les impide respirar y puede causar su muerte.
El acetileno, como producto, también puede contribuir a la formación de oxidantes fotoquímicos cuando reacciona con óxidos de nitrógeno y la luz solar. Estos oxidantes provienen de fuentes como los gases de escape de vehículos, la evaporación de solventes, procesos industriales y la quema de combustibles.
Riesgos para la Salud
Los alquinos se encuentran en algunos medicamentos recetados. Por ejemplo, un triple enlace carbono-carbono puede estar presente en medicamentos como el antirretroviral Efavirenz y el antifúngico Terbinafina.
Otros Riesgos
- Si los alquinos entran en contacto con superficies calientes o llamas, se descomponen y forman humos tóxicos y corrosivos.
- Inhalarlos puede causar mareos y dolores de estómago. Si entran en contacto con la piel, pueden resecarla y causar enrojecimiento. Ingerirlos puede provocar un fuerte dolor abdominal.
- Reaccionan violentamente con bases y oxidantes fuertes, lo que puede causar incendios y explosiones.
- La inhalación puede causar vértigo, somnolencia, pérdida de conocimiento e incluso la muerte.
- Pueden dañar algunos tipos de plástico, caucho y recubrimientos.
¿Cómo es la Estructura de los Alquinos?
Hibridación
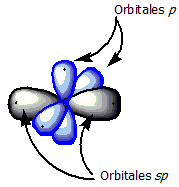
Los alquinos tienen una característica especial llamada hibridación sp. Esto significa que los orbitales de los átomos de carbono se combinan de una manera particular. Los orbitales sp son más pequeños que los de otros tipos de hidrocarburos, lo que hace que los enlaces entre los carbonos sean más cortos.
Por ejemplo, la distancia entre los átomos de carbono es de 1.53 Å en el etano (enlace simple), 1.34 Å en el etileno (enlace doble) y 1.20 Å en el acetileno (enlace triple). La distancia entre el carbono y el hidrógeno también se acorta.
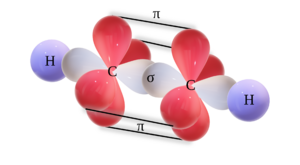
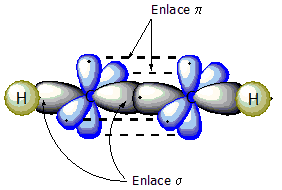
Un triple enlace carbono-carbono se forma cuando dos átomos de carbono con hibridación sp se unen. Los dos orbitales híbridos sp de cada carbono se colocan en un ángulo de 180°, formando una estructura lineal. Esto permite que se forme un enlace sigma (fuerte y directo) y dos enlaces pi (más débiles y laterales), creando así el triple enlace.
Esta hibridación sp da a los alquinos una forma lineal, lo cual es común en compuestos orgánicos con triples enlaces, como el etino, propino y butino.
- HIBRIDACIÓN DEL ETINO (CH≡CH)
El acetileno es una molécula lineal. La distancia entre los carbonos es de 1.20 Å, y entre el carbono y el hidrógeno es de 1.06 Å, con ángulos de enlace de 180°.
Para entender su hibridación, primero vemos la configuración electrónica de los átomos:
- C: Z=6; 1s2 2s2 2p2 (4 electrones de valencia)
- H: Z= 1; 1s1 (1 electrón de valencia)
Los electrones de valencia nos dicen cuántos enlaces puede formar cada átomo. El carbono puede formar 4 enlaces y el hidrógeno 1. En el etino, el carbono es el átomo central.
Luego, se hace un diagrama de orbitales para el carbono, donde los electrones se "promueven" para que el átomo pueda formar más enlaces.
Cuando una molécula tiene un triple enlace, significa que hay un enlace sigma y dos enlaces pi. Los enlaces pi no participan en la hibridación. Los enlaces sigma se forman por la unión frontal de orbitales, mientras que los enlaces pi se forman por la unión lateral de orbitales p que no están hibridados.
Finalmente, se dibuja la hibridación. Se representan dos orbitales ovalados (los híbridos sp) que forman una línea. Los orbitales p no hibridados se dibujan de forma perpendicular. Como el etino es CH≡CH, esta hibridación se representa en cada átomo de carbono. Los híbridos sp se unen con los orbitales s de los átomos de hidrógeno, formando enlaces sigma.
Véase también
 En inglés: Alkyne Facts for Kids
En inglés: Alkyne Facts for Kids
- Alqueno
- Alcano
- Química orgánica
- Hidrocarburo alifático
- Cicloalcano
Referencias