Electrón de valencia para niños
Los electrones de valencia son los electrones que se encuentran en la capa de energía más externa de un átomo. Estos electrones son muy importantes porque son los que participan en la formación de uniones entre átomos. Imagina que son como las "manos" de un átomo, que usa para unirse con otros.
Estos electrones son los que permiten que los átomos se unan de diferentes maneras. Pueden ser compartidos entre átomos, o un átomo puede cederlos o tomarlos de otro. La cantidad de estos electrones que tiene un átomo determina cuántas uniones puede formar.
Solo los electrones de la capa más externa de un átomo pueden ser atraídos por otros átomos cercanos. Los electrones que están más adentro del átomo no suelen participar en estas uniones.
La valencia de un elemento nos dice cuántos electrones necesita o le sobran para tener su capa más externa completa. Por ejemplo, los gases nobles (como el neón o el argón) tienen su última capa completa, por eso su valencia es cero y no suelen unirse con otros átomos. El sodio, en cambio, tiene un solo electrón en su última capa, así que su valencia es 1. Si pierde ese electrón, su capa anterior queda completa.
Un átomo que tiene su capa de electrones de valencia completa (como un gas noble) tiende a ser muy estable y no reacciona fácilmente. Los átomos que tienen uno o dos electrones de valencia extra son muy reactivos, porque les es fácil perder esos electrones para formar un ion positivo. Los átomos a los que les falta uno o dos electrones para completar su capa también son reactivos, ya que tienden a ganar esos electrones para formar un ion negativo, o a compartirlos para formar una unión covalente.
Un electrón de valencia puede absorber o liberar energía. Si gana energía, puede saltar a una capa más externa (a esto se le llama excitación atómica) o incluso liberarse del átomo, lo que forma un ion positivo. Si pierde energía, puede moverse a una capa interna que no esté llena.
Contenido
- ¿Cómo se determina el número de electrones de valencia?
- ¿Qué es la configuración electrónica y cómo afecta la valencia?
- ¿Cómo nos ayuda la espectroscopia a entender los electrones?
- ¿Cómo influyen los electrones de valencia en las reacciones químicas?
- ¿Cómo afectan los electrones de valencia la conductividad eléctrica?
- Véase también
¿Cómo se determina el número de electrones de valencia?
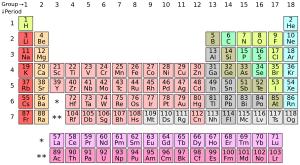
El número de electrones de valencia de un elemento se puede saber mirando el grupo (la columna vertical) en la tabla periódica donde se encuentra. Por ejemplo, el Litio está en el Grupo 1, lo que significa que tiene 1 electrón de valencia.
Para la mayoría de los grupos (excepto los metales de transición, que son los grupos 3-12), el último dígito del número de grupo te dice cuántos electrones de valencia tiene un átomo neutro de ese elemento.
| Grupo de la tabla periódica | Electrones de valencia |
|---|---|
| Grupo 1 (I) (metales alcalinos) | 1 |
| Grupo 2 (II) (metales alcalinotérreos) | 2 |
| Grupos 3-12 (metales de transición) | 2, 5 (estos son más complejos) |
| Grupo 13 (III) (Grupo del boro) | 3 |
| Grupo 14 (IV) (Grupo del carbono) | 4 |
| Grupo 15 (V) (Grupo del nitrógeno) | 5 |
| Grupo 16 (VI) (calcógenos) | 6 |
| Grupo 17 (VII) (halógenos) | 7 |
| Grupo 18 (gases nobles) | 8 (excepto el helio, que tiene 2) |
- El método general de contar electrones de valencia no es tan útil para los metales de transición. Se usa otro método.
- El helio es una excepción, solo tiene 2 electrones de valencia.
¿Qué es la configuración electrónica y cómo afecta la valencia?
Los electrones que determinan la valencia de un átomo (es decir, cómo reacciona químicamente) son los que tienen la energía más alta.
Para los elementos de los grupos principales (los que no son metales de transición), los electrones de valencia son los que están en la capa electrónica más externa. Así, el número de electrones de valencia depende de la configuración electrónica del átomo. Por ejemplo, el fósforo (P) tiene 5 electrones de valencia, lo que le permite formar hasta 5 uniones.
Sin embargo, los elementos de transición son un poco diferentes. Sus electrones de valencia no solo están en la capa más externa, sino también en una capa interna que tiene una energía muy similar. Por eso, los electrones "d" de los metales de transición también se consideran electrones de valencia, aunque no estén en la capa más externa. Por ejemplo, el manganeso (Mn) puede tener hasta siete electrones de valencia, lo que explica por qué puede formar uniones complejas.
Cuanto más a la derecha en la tabla periódica se encuentran los metales de transición, menos participan sus electrones "d" en las uniones. Por ejemplo, el níquel tiene muchos electrones de valencia, pero no forma tantas uniones como el manganeso. El zinc tiene una capa "d" completa, y sus electrones "d" casi no participan en las uniones.
¿Cómo nos ayuda la espectroscopia a entender los electrones?
La espectroscopia electrónica y de rayos X nos ha dado pruebas de que los electrones internos de un átomo no suelen participar en las uniones químicas. La energía necesaria para separar los electrones internos de un átomo es casi la misma, sin importar si el átomo está solo o formando parte de un compuesto. En cambio, la energía necesaria para separar los electrones externos sí cambia mucho dependiendo de cómo esté unido el átomo.
La espectroscopia es una herramienta muy valiosa para investigar la estructura y el movimiento de la materia, desde los átomos más pequeños hasta las moléculas más grandes. Nos ayuda a entender cómo la luz (radiación electromagnética) interactúa con los átomos y las moléculas, haciendo que sus electrones cambien de niveles de energía.
¿Cómo influyen los electrones de valencia en las reacciones químicas?
El número de electrones de valencia en un átomo controla cómo se une con otros. Por eso, los elementos que tienen el mismo número de electrones de valencia a menudo se agrupan en la tabla periódica.
Los metales más reactivos son los metales alcalinos del Grupo 1 (como el sodio o el potasio). Esto se debe a que tienen un solo electrón de valencia, que pierden fácilmente para formar un ion positivo con una capa completa. Los metales alcalinotérreos del Grupo 2 (como el magnesio) son un poco menos reactivos, porque necesitan perder dos electrones.
Dentro de cada grupo de metales, la reactividad aumenta a medida que bajamos en la tabla periódica. Esto es porque los elementos más pesados tienen más capas de electrones, y sus electrones de valencia están más lejos del núcleo y, por lo tanto, son más fáciles de perder.
Los no metales tienden a atraer electrones de valencia adicionales para completar su capa. Esto puede ocurrir de dos maneras: compartiendo electrones con otro átomo (una unión covalente) o quitando electrones de otro átomo (una unión iónica). Los no metales más reactivos son los halógenos (como el flúor o el cloro). A estos átomos solo les falta un electrón para completar su capa.
Dentro de cada grupo de no metales, la reactividad disminuye a medida que bajamos en la tabla periódica. Esto se debe a que los electrones de valencia están menos unidos al núcleo en los elementos más pesados.
En muchos casos, la valencia de un átomo es igual al número de electrones que gana, pierde o comparte para lograr una capa externa estable (la "regla del octeto"). Sin embargo, hay muchas moléculas que no siguen esta regla.
¿Cómo afectan los electrones de valencia la conductividad eléctrica?
Los electrones de valencia también son clave para entender por qué algunos elementos conducen bien la electricidad (metales), otros no la conducen (aislantes) y otros tienen una conductividad intermedia (semiconductores).
Los elementos metálicos suelen ser muy buenos conductores de electricidad cuando están en estado sólido. En la tabla periódica, los metales están a la izquierda y tienen menos electrones de valencia que los no metales. Sin embargo, los electrones de valencia de un átomo metálico se pueden mover con mucha libertad entre los átomos. Esta situación se conoce como enlace metálico. Estos electrones "libres" pueden moverse si se aplica una fuerza eléctrica, creando una corriente eléctrica. El cobre, el aluminio, la plata y el oro son ejemplos de buenos conductores.
Un elemento no metálico tiene una baja conductividad eléctrica; actúa como un aislante eléctrico. Estos elementos se encuentran a la derecha de la tabla periódica y tienen su capa de valencia al menos medio llena (excepto el boro). Necesitan mucha energía para que sus electrones se muevan, por lo que solo pueden conducir corrientes eléctricas muy pequeñas. Ejemplos de aislantes sólidos son el diamante (una forma de carbono) y el azufre.
Un compuesto sólido que contiene metales también puede ser un aislante si los electrones de valencia de los átomos metálicos se usan para formar uniones iónicas. Por ejemplo, aunque el sodio es un metal, el cloruro de sodio (sal de mesa) es un aislante, porque el electrón de valencia del sodio se transfiere al cloro para formar una unión iónica, y ese electrón ya no puede moverse libremente.
Un semiconductor tiene una conductividad eléctrica que está entre la de un metal y la de un no metal. A diferencia de los metales, la conductividad de un semiconductor aumenta con la temperatura. Ejemplos típicos de semiconductores son el silicio y el germanio, cada uno con cuatro electrones de valencia. Sus propiedades se explican por una pequeña diferencia de energía entre la banda de valencia (donde están los electrones de valencia) y la banda de conducción (a donde los electrones pueden saltar con energía térmica).
Véase también
 En inglés: Valence electron Facts for Kids
En inglés: Valence electron Facts for Kids