Enlace iónico para niños
Un enlace iónico o electrovalente es un tipo de unión química que se forma por la atracción entre partículas con cargas opuestas, llamadas iones. Esto ocurre cuando un átomo le quita electrones a otro. Generalmente, un átomo de un no metal es el que toma los electrones.
La atracción entre los iones con carga opuesta (uno positivo, llamado catión, y uno negativo, llamado anión) hace que se unan y formen un compuesto químico. Es como si uno de los átomos "dona" electrones y el otro los "recibe". Para que se forme un enlace iónico, la diferencia en la capacidad de los átomos para atraer electrones (llamada electronegatividad) debe ser grande, generalmente mayor o igual a 1.7 en la Escala de Pauling.
Es importante saber que ningún enlace es completamente iónico. Siempre hay una pequeña parte de "compartición" de electrones, como en los enlaces covalentes. Sin embargo, el modelo del enlace iónico es muy útil para entender y predecir cómo se comportan muchos compuestos.
Como los elementos que forman estos enlaces tienen grandes diferencias de electronegatividad, el enlace iónico suele darse entre un metal y un no metal. El metal cede uno o más electrones, convirtiéndose en un catión (ion positivo) con una configuración electrónica estable. Estos electrones son tomados por el no metal, que se convierte en un anión (ion negativo) y también alcanza una configuración electrónica estable. Esto suele significar que ambos átomos tienen 8 electrones en su capa más externa, siguiendo la regla del octeto. Hay algunas excepciones, como el hidrógeno (2 electrones), el berilio (4 electrones), y el aluminio y el boro (6 electrones).
Los compuestos iónicos forman estructuras ordenadas llamadas redes cristalinas. En estas redes, los iones de carga opuesta se unen por fuerzas electrostáticas. Estas fuerzas son las que determinan las propiedades de los compuestos. Si la atracción es muy fuerte, se forman sólidos cristalinos con punto de fusión muy alto y que no se disuelven en agua. Si la atracción es menor, como en el cloruro de sodio (sal de mesa), el punto de fusión es más bajo y suelen ser solubles en agua.
Contenido
¿Qué características tienen los enlaces iónicos?
Los enlaces iónicos tienen varias características importantes:
- Son enlaces muy fuertes, aunque su fuerza puede variar según los iones involucrados.
- A temperatura ambiente, la mayoría son sólidos y tienen una estructura cristalina, a menudo transparente.
- Tienen punto de fusión y ebullición muy altos, generalmente entre 300 °C y 1000 °C.
- Se forman comúnmente entre metales de los grupos I y II de la tabla periódica, y no metales de los grupos VI y VII.
- Muchos son solubles en agua. Esto se debe a que las moléculas de agua pueden rodear y separar los iones.
- Cuando se disuelven en disolución acuosa (en agua), son excelentes conductores de electricidad. Esto ocurre porque los iones quedan libres y pueden moverse.
- En estado sólido, no conducen la electricidad. Esto es porque los iones están fijos en la red cristalina y no pueden moverse libremente. Por ejemplo, un bloque de sal no conduce electricidad, pero si disuelves sal en agua, la solución sí la conduce.
- Solo tienen enlaces simples.
Tipos de iones en los enlaces iónicos
Los iones se clasifican en dos tipos principales:
Aniones: Iones con carga negativa
Un Anión es un ion que tiene carga eléctrica negativa. Esto significa que sus átomos tienen más electrones de los que normalmente tendrían. Los aniones suelen formarse a partir de no metales.
Algunos ejemplos comunes de aniones son:
Cationes: Iones con carga positiva
Un Catión es un ion que tiene carga eléctrica positiva. Los cationes más comunes se forman a partir de metales.
Algunos ejemplos comunes de cationes son:
¿Cómo se forman los enlaces iónicos?
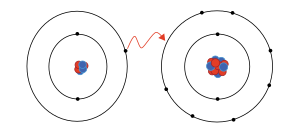
Un enlace iónico se forma cuando un átomo (generalmente un metal) que tiene pocos electrones en su capa exterior, los cede para parecerse a un gas noble (que son muy estables). Al ceder electrones, este átomo se convierte en un catión (ion positivo).
Otro átomo (generalmente un no metal) que necesita electrones para completar su capa exterior, los acepta del primer átomo. Al aceptar electrones, este átomo se convierte en un anión (ion negativo). La atracción entre estos iones positivos y negativos es lo que forma el enlace iónico.
Por ejemplo, la sal de mesa, el cloruro de sodio (NaCl), se forma así: Cuando el sodio (Na) y el cloro (Cl) se unen, cada átomo de sodio pierde un electrón y se convierte en un catión (Na+). Cada átomo de cloro gana un electrón y se convierte en un anión (Cl-). Luego, estos iones se atraen entre sí en una proporción de 1 a 1 para formar cloruro de sodio.
- Na + Cl → Na+ + Cl− → NaCl
Muchos compuestos iónicos se llaman sales. También pueden formarse cuando un hidróxido (como el NaOH) reacciona con un ácido (como el HCl).
- NaOH + HCl → NaCl + H2O
La energía necesaria para que un átomo ceda electrones y se forme un catión puede aumentar la energía del sistema. Sin embargo, cuando el otro átomo acepta esos electrones y los iones se atraen, se libera mucha energía. Esto hace que la formación del enlace iónico sea favorable y el sistema sea más estable.
La fuerza del enlace iónico depende mucho de la carga de los iones. Por ejemplo, un compuesto con iones de carga +2 y -2 (como C2+A2−) tendrá un enlace iónico mucho más fuerte que uno con iones de carga +1 y -1 (como C+A−), según la ley de Coulomb.
¿Qué tan fuerte es un enlace iónico?
La fuerza de un enlace iónico en un sólido cristalino se mide con algo llamado energía reticular. Esta energía es la cantidad de energía que se libera cuando los iones gaseosos se unen para formar el sólido. Se puede calcular y también medir experimentalmente.
Las fuerzas de atracción en los enlaces iónicos son muy fuertes, generalmente entre 170 y 1500 kJ/mol. Esto explica por qué los compuestos iónicos suelen ser sólidos duros con altos puntos de fusión.
Véase también
 En inglés: Ionic bond Facts for Kids
En inglés: Ionic bond Facts for Kids
- Regla del octeto
- Enlace covalente
- Enlace metálico
- Ley de Coulomb
- Polaridad (química)
- Configuración electrónica