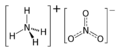
Nitrato de amonio para niños
Datos para niños
Nitrato de amonio |
||
|---|---|---|
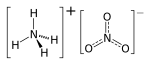 Estructura química.
|
||
 Estructura tridimensional.
|
||
 Sales de nitrato de amonio
|
||
| Nombre IUPAC | ||
| Trioxidonitrato de amonio | ||
| General | ||
| Otros nombres | Nitrato de amonio Nitrato amónico |
|
| Fórmula estructural | Ver imagen | |
| Fórmula molecular | NH4NO3 | |
| Identificadores | ||
| Número CAS | 6484-52-2 | |
| Número RTECS | BR9050000 | |
| ChEBI | 63038 | |
| ChEMBL | CHEMBL1500032 | |
| ChemSpider | 21511 | |
| PubChem | 22985 | |
| UNII | T8YA51M7Y6 | |
|
InChI
InChI=InChI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1
Key: DVARTQFDIMZBAA-UHFFFAOYSA-O |
||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1720 kg/m³; 1,72 g/cm³ | |
| Masa molar | 80,043 g/mol | |
| Punto de fusión | 442 K (169 °C) | |
| Punto de ebullición | 483 K (210 °C) | |
| Punto de descomposición | 483 K (210 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 118 g/100 ml (0 °C) 150 g/100 ml (20 °C) 297 g/100 ml (40 °C) 410 g/100 ml (60 °C) 576 g/100 ml (80 °C) 1024 g/100 ml (100 °C) |
|
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0líquido | -359,6 kJ/mol | |
| ΔfH0sólido | -366 kJ/mol | |
| S0sólido | 151 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
2
3
OX
|
|
| Riesgos | ||
| Ingestión | Peligroso en grandes cantidades. | |
| Inhalación | Muy peligroso, puede ser fatal. | |
| Piel | Puede causar irritación. | |
| Ojos | Puede causar irritación. | |
| LD50 | 2085–5300 mg/kg (oral en ratas) | |
| Más información | Hazardous Chemical Database (En inglés) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El nitrato de amonio es una sustancia química que se forma a partir de iones de nitrato y amonio. Su fórmula química es NH4NO3. Es un compuesto de color blanco, que absorbe la humedad del aire (higroscópico) y se disuelve muy bien en agua. El nitrato de amonio es un compuesto que puede ser inestable y se usa principalmente como fertilizante. En 2017, se produjeron alrededor de 21.6 millones de toneladas en todo el mundo.
Contenido
- ¿Cómo se obtiene el nitrato de amonio?
- ¿Para qué se usa el nitrato de amonio?
- ¿Cómo se fabrica el nitrato de amonio?
- Evaporación: La segunda etapa
- Manejo y almacenamiento seguros
- Información sobre el transporte
- Incidentes importantes relacionados con el nitrato de amonio
- Galería de imágenes
- Véase también
¿Cómo se obtiene el nitrato de amonio?
Producción en la industria
El nitrato de amonio se fabrica al combinar ácido nítrico con hidróxido de amonio. Después de esta mezcla, se evapora el agua para obtener el producto final.
<chem display="block">NH4OH + HNO3 -> NH4NO3 + H2O </chem>
En el año 2000, la Asociación Europea de Fabricantes de Fertilizantes (EFMA) publicó una guía sobre las mejores formas de producir nitrato de amonio de manera segura en Europa. Actualmente, existen varios métodos para su producción industrial. La elección del método depende de factores comerciales y de las características deseadas del producto.
Producción en laboratorio
En un laboratorio, se puede obtener nitrato de amonio mezclando sulfato de amonio (NH4)2SO4 y nitrato de estroncio [Sr(NO3)2] en una solución. Luego, el sulfato de estroncio se separa, y al evaporar la solución restante, se obtiene nitrato de amonio en forma de cristales o polvo blanco.
<chem display="block">(NH4)2SO4{}_{(aq)} + SrNO3{}_{(aq)} -> 2NH4NO3{}_{(aq)} + SrSO4 v (blanco) </chem>
¿Para qué se usa el nitrato de amonio?
El nitrato de amonio tiene varios usos importantes en diferentes industrias.
Uso como fertilizante
El uso más común del nitrato de amonio es como fertilizante para las plantas, ya que contiene mucho nitrógeno. El nitrato es absorbido directamente por las plantas. El amonio, por su parte, es transformado por los microorganismos del suelo en nitrito y luego en nitrato, lo que proporciona un alimento duradero para las plantas.
El nitrato de amonio se vende en pequeños gránulos para facilitar su uso como fertilizante. Es más estable que otros fertilizantes como la urea y no pierde su nitrógeno tan rápido en el aire.
Uso en la industria química
El nitrato de amonio también se utiliza en la industria química para:
- Tratar minerales de titanio.
- Producir óxido nitroso (N2O) mediante un proceso controlado de calentamiento. Esta reacción libera calor y puede ser peligrosa si no se maneja correctamente.
- Fabricar kits de frío instantáneo, ya que al disolverse en agua, absorbe mucho calor y enfría rápidamente.
- En algunos kits de supervivencia, al mezclarse con polvo de Zinc y cloruro de amonio, puede encenderse al contacto con el agua.
Uso en materiales para minería y construcción
El nitrato de amonio es un componente en ciertos materiales utilizados en minería y obras civiles. Por ejemplo, se mezcla con fuel oil para crear un material llamado ANFO. Este material es económico y fácil de usar en la minería de carbón, minería a cielo abierto y en proyectos de construcción.
En su estado puro, el nitrato de amonio también puede ser un material con potencial de reacción, aunque es bastante estable a temperaturas normales. Si se mezcla con polvo de aluminio, puede aumentar su energía.
¿Cómo se fabrica el nitrato de amonio?
La fabricación del nitrato de amonio implica una reacción química entre el amoníaco y el ácido nítrico. Esta reacción es muy rápida y libera mucho calor. Este calor se puede usar para evaporar el agua de la solución de nitrato de amonio y producir vapor.
El nitrato de amonio puro se descompone a 169 °C y hierve a 230 °C. Es importante controlar la temperatura y la concentración de los materiales durante el proceso para evitar problemas como la corrosión de los equipos o la pérdida de sustancias.
El proceso de fabricación tiene tres pasos principales:
- La mezcla del amoníaco con el ácido nítrico (neutralización).
- La evaporación del agua de la solución.
- El control del tamaño de las partículas y las características del producto final.
Neutralización: La primera etapa
La neutralización es una reacción muy rápida que libera mucho calor. Para que funcione bien en la industria, se necesitan estas condiciones:
- Una excelente mezcla de los materiales.
- Un control muy preciso del pH (la acidez o alcalinidad). Los sistemas modernos usan válvulas automáticas para mantener la proporción correcta de amoníaco y ácido nítrico.
- Un control de la temperatura en el reactor para evitar que se caliente demasiado. Si la temperatura sube mucho, puede haber riesgos. También se controla para evitar que los materiales se escapen como vapor.
En la práctica, los procesos industriales varían en cómo mezclan los materiales y controlan la temperatura. El calor que se produce en esta etapa se puede usar para calentar los materiales iniciales o para evaporar el agua de la solución de nitrato de amonio.
Tipos de neutralizadores
Los equipos donde ocurre la neutralización se clasifican según la temperatura de la reacción:
- Por debajo del punto de ebullición atmosférico: Trabajan a baja temperatura, lo que reduce la corrosión y hace el proceso más seguro. Sin embargo, pueden ser más complejos y consumir más energía.
- En el punto de ebullición atmosférico: Trabajan a temperaturas más altas (entre 150 y 200 °C). Son eficientes y tienen pocas pérdidas de material. Pero el vapor que se produce puede contaminarse, lo que requiere equipos de acero inoxidable.
- Sobre el punto de ebullición atmosférico: Estos neutralizadores usan presión (entre 2 y 6 bar) para elevar la temperatura hasta unos 180 °C. Son los más adecuados para una alta producción.
También se clasifican según cómo aprovechan el calor de la reacción:
- Sin uso de calor: No se usan en plantas modernas.
- Con uso de calor: El calor de la reacción se usa para calentar la mezcla y evaporar parte del agua.
- Con doble uso de calor: El calor se usa para evaporar agua y para producir vapor, que luego se usa para precalentar los materiales y concentrar la solución.
Finalmente, se clasifican por la presión de los vapores que se producen:
- Procesos de flash a vacío: Son más simples o más complejos, con diferentes niveles de recuperación de calor.
- Procesos con neutralización a presión atmosférica: Trabajan a la presión normal del aire.
- Procesos con neutralización bajo presión: Trabajan a presiones más altas.
Neutralización a presión inferior a la atmosférica (a vacío)
En estos sistemas, el calor de la reacción hace que la mezcla se caliente y el agua se evapore. Para controlar la temperatura, se enfría y se recircula parte del nitrato de amonio producido. Esto permite mantener la temperatura entre 100 y 120 °C. Sin embargo, se obtienen soluciones con bajas concentraciones de nitrato de amonio.
Estos neutralizadores pueden tener una o varias etapas. En los de varias etapas, se pueden obtener soluciones con una concentración de hasta el 98% de nitrato de amonio.
- Ventajas: Menos problemas de corrosión y mayor seguridad.
- Inconvenientes: Los equipos son grandes y caros. Se aprovecha poco el calor de la reacción, lo que significa menor eficiencia energética.
Neutralización a presión atmosférica
Estos equipos son más sencillos y trabajan a temperaturas más altas (entre 150 y 200 °C). El vapor que producen contiene la mayor parte del agua del ácido nítrico y se usa para precalentar los materiales.
Se pueden obtener concentraciones de nitrato de amonio de hasta el 98%. A menudo se usan dos neutralizadores en serie para un mejor control del pH.
- Ventajas: Temperaturas moderadas, lo que reduce el riesgo de descomposición.
- Inconvenientes: Los sistemas para limpiar el vapor son grandes y caros. La baja temperatura del vapor limita su uso para otras aplicaciones, lo que resulta en una baja eficiencia energética.
Neutralización a sobrepresión
Existen dos tipos de procesos a sobrepresión:
- Presión media (hasta 4 atm): Son los más comunes en la industria. La temperatura de reacción no es tan alta como para ser peligrosa, y permiten usar el vapor para concentrar la solución.
- Alta presión (más de 4 atm): Se usan entre 4 y 6 atm, elevando la temperatura a unos 200 °C.
- Ventajas: Menores costos de inversión y mayor eficiencia energética, ya que los vapores a alta presión se pueden usar para calentar los materiales y en el evaporador.
- Inconvenientes: Mayor presión y temperatura causan más corrosión y pérdidas de nitrógeno y nitrato de amonio, lo que aumenta el costo de los materiales de los equipos.
Evaporación: La segunda etapa
Después de la neutralización, la solución de nitrato de amonio pasa por un proceso de evaporación para eliminar el agua y aumentar su concentración. Los métodos han evolucionado con el tiempo. Antes de 1945, se evaporaba hasta una alta concentración y luego se enfriaba. Más tarde, se usaron evaporadores de película que contenían poca cantidad de material, lo que era más seguro.
Desde 1965, se usan evaporadores al vacío en las fábricas modernas. Estos son más eficientes y se controlan con precisión. Las partes de la unidad donde la concentración es muy alta (más del 99%) están diseñadas para contener solo pequeñas cantidades de solución, por razones de seguridad. Esto ayuda a evitar la contaminación y posibles incidentes.
Las soluciones de nitrato de amonio pueden tener entre 78% y 98% de concentración. Los procesos para solidificar el producto final requieren diferentes niveles de agua. Por eso, hay muchos tipos de evaporadores, cada uno adaptado a las necesidades del producto.
Manejo y almacenamiento seguros
Es muy importante manejar y almacenar el nitrato de amonio con cuidado para evitar accidentes.
- Manejo: Se debe asegurar una buena ventilación en el área. Es necesario usar protección para los ojos y las manos.
- Almacenamiento: Los tanques deben estar lejos de sustancias que puedan quemarse. Hay que proteger los tanques de la corrosión y de daños físicos. Es importante revisar el pH de la solución a diario. Si el pH de una solución al 10% es menor de 4.5, se debe añadir amoníaco gaseoso hasta alcanzar ese pH. El acero inoxidable es un material adecuado para los recipientes. No se debe fumar en las áreas de almacenamiento y se deben usar lámparas protegidas.
Medidas de seguridad importantes
- Límites de exposición: No hay límites oficiales específicos.
- Precauciones y equipos: Evitar respirar los vapores y asegurar una ventilación adecuada. Es fundamental tener equipos lava-ojos y duchas de seguridad disponibles donde pueda haber contacto con los ojos o la piel.
- Protección personal: En caso de emergencia, se deben usar equipos de respiración especiales. También se deben usar guantes resistentes al calor y ropa de protección. Es obligatorio usar gafas de seguridad química o una pantalla facial.
Información sobre el transporte
El nitrato de amonio está clasificado como una sustancia peligrosa para su transporte.
- Clasificación ONU: Clase 5, división 5.1 —Comburente— N.º ONU: 2426.
- En España, está regulado por el RD. 1254/1999 sobre el control de riesgos de accidentes graves y el RD. 145/1989 sobre la admisión, manipulación y almacenamiento de materias peligrosas en puertos.
- En México, es un producto regulado por la Secretaría de la Defensa Nacional (SEDENA) bajo la "Ley Federal de Armas de Fuego y Explosivos" y su Reglamento.
Incidentes importantes relacionados con el nitrato de amonio
A lo largo de la historia, ha habido varios incidentes graves relacionados con el almacenamiento o manejo inadecuado del nitrato de amonio, que demuestran la importancia de seguir estrictas medidas de seguridad.
- 1942, Tessenderlo, Bélgica: Una explosión accidental de 150 toneladas de nitrato de amonio causó un gran número de víctimas y heridos.
- 1947, Texas, Estados Unidos: Un barco cargado con nitrato de amonio explotó en el puerto industrial de Texas City, resultando en un desastre con muchas personas afectadas y daños extensos en la ciudad.
- 2015, Explosiones de Tianjin, China: El 12 de agosto de 2015, una explosión en un almacén del puerto de Tianjin, que contenía materiales peligrosos como nitrato de amonio, causó un gran número de fallecidos y heridos.
- 2020, Explosiones de Beirut, Líbano: El 4 de agosto de 2020, una explosión en un almacén del Puerto de Beirut que contenía 2750 toneladas de nitrato de amonio confiscado, provocó una catástrofe con muchas personas fallecidas, miles de heridos y daños masivos en la ciudad.
Galería de imágenes
Véase también
 En inglés: Ammonium nitrate Facts for Kids
En inglés: Ammonium nitrate Facts for Kids