Teoría del campo cristalino para niños
La teoría de campo cristalino (TCC) es un modelo científico que nos ayuda a entender cómo se comportan los electrones en ciertos compuestos químicos. Se usa principalmente para estudiar los compuestos que forman los metales de transición, como el hierro o el cobre, cuando se unen a otras moléculas o iones llamados "ligandos".
Esta teoría es muy útil porque explica por qué estos compuestos tienen colores tan brillantes y por qué algunos son magnéticos. También ayuda a entender cómo se organizan sus átomos en el espacio. La TCC fue creada por los científicos Hans Bethe y John Hasbrouck van Vleck en la década de 1930. Más tarde, se combinó con otras ideas para formar una teoría más completa llamada "teoría del campo de ligandos".
Contenido
¿Qué es la Energía de Estabilización de Campo Cristalino?
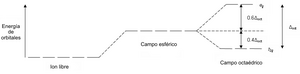
La energía de estabilización de campo cristalino (EECC) es una forma de medir cuán estables son los compuestos de metales de transición. Imagina que los electrones en un átomo de metal tienen diferentes "lugares" o niveles de energía donde pueden estar, llamados orbitales d.
Cuando un metal de transición se une a los ligandos, estos orbitales d se separan en diferentes grupos de energía. Algunos de estos grupos tienen una energía más baja de lo normal, y otros una energía más alta. Si los electrones ocupan los orbitales de menor energía, el compuesto se vuelve más estable. Esta estabilidad extra es lo que llamamos EECC.
Por ejemplo, en una forma común de estos compuestos (llamada octaédrica), algunos orbitales d bajan su energía y otros la suben. Los electrones que van a los orbitales de menor energía hacen que el compuesto sea más estable.
La EECC nos ayuda a predecir la forma que tendrán estos compuestos. Por ejemplo, muchos compuestos con ocho electrones en sus orbitales d tienen una forma plana y cuadrada porque esta forma les da una gran estabilidad.
¿Por qué los compuestos de transición tienen colores?
Una de las cosas más interesantes que explica la teoría de campo cristalino es por qué muchos compuestos de metales de transición tienen colores tan vivos.
Cuando los orbitales d de un metal se separan en diferentes niveles de energía, como explicamos antes, ocurre algo especial. Si la luz blanca (que contiene todos los colores) incide sobre el compuesto, los electrones de los niveles de energía más bajos pueden absorber parte de esa luz. Al absorber la energía de un color específico, el electrón "salta" a un nivel de energía más alto.
La luz que no es absorbida es la que vemos. Por ejemplo, si un compuesto absorbe la luz roja, nuestros ojos verán el color verde, que es el color opuesto o complementario al rojo.
La cantidad de energía que los electrones necesitan para saltar depende de qué tan separados estén los niveles de energía de los orbitales d. Esta separación, a su vez, depende de los ligandos que estén unidos al metal.
- Si los ligandos son "débiles", la separación de energía es pequeña. Esto significa que los electrones absorben luz de baja energía (como el rojo o el naranja), y vemos colores como el verde o el azul.
- Si los ligandos son "fuertes", la separación de energía es grande. Los electrones absorben luz de alta energía (como el violeta o el azul), y vemos colores como el amarillo o el naranja.
Por eso, al cambiar los ligandos, podemos cambiar el color del compuesto.
¿Qué color se observa?
La siguiente tabla te muestra qué color verás si un compuesto absorbe un color específico de la luz.
Longitud de onda absorbida (nm) y color observado
- 400 nm (violeta absorbido) → se observa verde-amarillo (560 nm)
- 450 nm (azul absorbido) → se observa amarillo (600 nm)
- 490 nm (verde-azul absorbido) → se observa rojo (620 nm)
- 570 nm (verde-amarillo absorbido) → se observa violeta (410 nm)
- 580 nm (amarillo absorbido) → se observa azul oscuro (430 nm)
- 600 nm (naranja absorbido) → se observa azul (450 nm)
- 650 nm (rojo absorbido) → se observa verde (520 nm)
Galería de imágenes
Véase también
 En inglés: Crystal field theory Facts for Kids
En inglés: Crystal field theory Facts for Kids
- Complejo (química)
- Teoría del campo de los ligantes
- Teoría de los orbitales moleculares
- Teoría de la repulsión de los pares de electrones de valencia