Sulfato para niños
Los sulfatos son un tipo de sales o ésteres que provienen del ácido sulfúrico. Imagina un pequeño grupo de átomos: en el centro hay un átomo de azufre, y a su alrededor, como si fueran las esquinas de una pirámide de cuatro lados (un tetraedro), hay cuatro átomos de oxígeno. Los sulfatos, así como los ácidos y peróxidos relacionados, se usan mucho en diferentes industrias.
Contenido
¿Cómo son los sulfatos?
El grupo de átomos llamado ion sulfato tiene un átomo central de azufre rodeado por cuatro átomos de oxígeno. Estos átomos de oxígeno están colocados de forma que forman una figura geométrica llamada tetraedro, similar a la forma de una molécula de metano. El átomo de azufre tiene una carga positiva (+6), y cada uno de los cuatro átomos de oxígeno tiene una carga negativa (-2). En total, el ion sulfato tiene una carga negativa de -2.
Los ésteres de sulfato orgánicos, como el sulfato de dimetilo, son compuestos que se forman a partir del ácido sulfúrico y otras moléculas orgánicas. La forma tetraédrica del ion sulfato se explica por una teoría llamada VSEPR, que ayuda a predecir cómo se organizan los átomos en una molécula.
Tipos de sulfatos y dónde los encontramos
Los sulfatos inorgánicos son las sales que se forman directamente del ácido sulfúrico. En la naturaleza, puedes encontrar sulfatos en minerales comunes como:
- Yeso (o aljez): Es sulfato de calcio con agua (CaSO4·2 H2O).
- Baritina: Es sulfato de bario.
- Sulfato de sodio (Na2SO4).
Estos sulfatos naturales a veces se forman cuando otros minerales llamados sulfuros entran en contacto con el oxígeno del aire y se oxidan.
¿Cómo se fabrican los sulfatos?
La mayoría de los sulfatos se pueden crear combinando una base con ácido sulfúrico. También se pueden formar haciendo reaccionar el ácido sulfúrico directamente con un metal.
Usos de los sulfatos
Los sulfatos tienen muchísimas aplicaciones, y sus usos dependen del metal al que estén unidos:
- El sulfato de sodio se usa para fabricar vidrio y como ingrediente en los detergentes.
- El sulfato de cobre se utiliza en la producción de un material llamado viscosa, en la fabricación de fertilizantes para plantas y como pesticida para controlar plagas.
- El yeso y la barita son muy importantes en la construcción y como aditivos para fabricar papel y cartulina.
- El sulfato de bario también se usa en medicina para hacer radiografías especiales que ayudan a ver el interior del cuerpo.
Los sulfatos también forman parte de unas sales dobles llamadas alumbres. El alumbre más conocido es el alumbre de sodio, que contiene Sodio y Aluminio.
¿Cómo se detectan los sulfatos?
Para saber si hay sulfatos solubles en una sustancia, se puede añadir cloruro de bario. Si hay sulfatos, se forma un sólido blanco llamado sulfato de bario (BaSO4) que se ve como un polvo en el líquido. Esta es una prueba común en los laboratorios.
Sulfatos orgánicos
Los sulfatos orgánicos son un tipo de ésteres del ácido sulfúrico. Se pueden formar a partir de un alcohol y ácido sulfúrico, o de otras maneras. Algunas de estas sustancias deben manejarse con cuidado. El sulfato orgánico más conocido es el sulfato de dimetilo, que se usa en ciertas reacciones químicas.
Propiedades de los sulfatos
Muchos sulfatos se disuelven fácilmente en agua. Sin embargo, hay algunas excepciones que no se disuelven bien, como el sulfato de calcio, el sulfato de estroncio, el sulfato de plomo(II), el sulfato de bario, el sulfato de plata y el sulfato de mercurio. El sulfato de radio es el sulfato que menos se disuelve.
La baja solubilidad del sulfato de bario es útil en el laboratorio. Si añades una solución de una sal de bario (como el cloruro de bario) a una solución que contiene iones sulfato, el sulfato de bario se precipitará (se volverá un sólido) y aparecerá como un polvo blanquecino. Esta es una forma común de comprobar si hay iones sulfato presentes.
Preparación de sulfatos
Los sulfatos de metales se pueden preparar de varias maneras:
- Usando ácido sulfúrico para disolver el metal:
- <chem>Zn + H2SO4 -> ZnSO4 + H2</chem>
- Neutralizando un hidróxido o un óxido con ácido sulfúrico:
- <chem>Cu(OH)2 + H2SO4 -> CuSO4 + 2H2O</chem>
- <chem>Fe2O3 + 3H2SO4 -> Fe2(SO4)3 + 3H2O</chem>
- Mediante una reacción de sustitución con otra sal:
- <chem>CdCO3 + H2SO4 -> CdSO4 + H2O + CO2</chem>
- <chem>2NaCl + H2SO4 -> Na2SO4 + 2HCl</chem>
- Oxidando sulfuros o sulfitos de metales.
Aplicaciones comerciales importantes
Los sulfatos son muy importantes en la industria. Algunos de los más usados son:
- Yeso: Es la forma natural del sulfato de calcio hidratado y se usa para producir yeso de construcción. La industria de la construcción utiliza alrededor de 100 millones de toneladas al año.
- Sulfato de cobre: Se usa para controlar algas y como electrolito en algunas pilas.
- Sulfato de hierro(II): Es una forma común de hierro que se encuentra en suplementos para personas, animales y para el suelo de las plantas.
- Sulfato de magnesio (conocido como sales de Epsom): Se usa en baños terapéuticos.
- Sulfato de plomo(II): Se forma en las placas de las batería de plomo-ácido cuando se descargan.
- Lauril éter sulfato sódico (SLES): Es un detergente común en los champús.
- Polihalita: Se usa como fertilizante.
Sulfatos en la naturaleza
Algunos microorganismos, como las bacterias reductoras de sulfatos que viven en lugares sin oxígeno (como los sedimentos o cerca de los respiraderos volcánicos en el fondo del mar), usan los sulfatos para obtener energía. Hacen esto al combinar la reducción de sulfatos con la oxidación de otras sustancias.
Historia de los sulfatos
Los alquimistas, que eran científicos antiguos, ya conocían algunos sulfatos. A las sales de vitriolo las llamaron así porque eran algunos de los primeros cristales transparentes que se conocían. Por ejemplo:
- El vitriolo verde era sulfato de hierro(II).
- El vitriolo azul era sulfato de cobre(II).
- El vitriolo blanco era sulfato de zinc.
El alumbre, que es un sulfato doble de potasio y aluminio, fue muy importante en el desarrollo de la industria química.
Efectos de los sulfatos en el medio ambiente
Los sulfatos pueden encontrarse en el aire como partículas muy pequeñas (aerosoles). Estas partículas se forman por la quema de combustibles fósiles (como el carbón o el petróleo) y de biomasa. Cuando hay muchos sulfatos en el aire, pueden aumentar la acidez de la atmósfera y contribuir a la lluvia ácida.
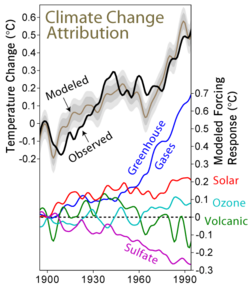
Impacto en el clima
Los sulfatos en la atmósfera tienen un efecto importante en el clima:
- Dispersión de la luz: Los sulfatos reflejan la luz del sol de vuelta al espacio. Esto hace que la Tierra absorba menos calor del sol y ayuda a enfriar el planeta. Este efecto es más notable en zonas con mucha actividad industrial.
- Formación de nubes: Los aerosoles de sulfato pueden actuar como "semillas" para que se formen las gotas de agua en las nubes. Esto puede llevar a que se formen más gotas de agua, pero más pequeñas. Muchas gotas pequeñas pueden reflejar la luz del sol de manera más eficiente que unas pocas gotas grandes, lo que también contribuye a un efecto de enfriamiento.
Estos efectos de enfriamiento de los sulfatos compensan un poco el calentamiento causado por los gases de efecto invernadero. Los sulfatos también están relacionados con el "oscurecimiento global", un fenómeno en el que la cantidad de luz solar que llega a la superficie de la Tierra ha disminuido en algunas décadas.
Los sulfatos también son el principal componente de los aerosoles que se forman en la estratosfera (una capa alta de la atmósfera) cuando volcanes grandes, como la erupción del Monte Pinatubo en Filipinas en 1991, lanzan dióxido de azufre. Estos aerosoles volcánicos también tienen un efecto de enfriamiento en el clima durante uno o dos años.
Galería de imágenes
-
Estructura del ion sulfato.