Carbocatión para niños
Un carbocatión es un átomo de carbono que tiene una carga eléctrica positiva. Imagina que el átomo de carbono es como una persona a la que le faltan dos amigos para completar su grupo de ocho. Normalmente, los átomos de carbono son más estables cuando tienen ocho electrones en su capa más externa (llamada capa de valencia). Pero un carbocatión solo tiene seis electrones en esa capa.
Debido a que le faltan electrones, un carbocatión es muy reactivo. Es como si estuviera buscando desesperadamente esos dos electrones que le faltan para sentirse completo y volver a tener una carga neutra. La forma de un carbocatión es plana, como un triángulo, lo que le permite interactuar fácilmente con otras moléculas.
Contenido
Carbocationes: Pequeñas Partículas con Carga Positiva
Los carbocationes son muy importantes en la química, especialmente en la química orgánica, que estudia las moléculas que contienen carbono. Son como "intermediarios" que aparecen por un momento durante algunas reacciones químicas, ayudando a que las moléculas se transformen.
¿Cómo se Descubrieron los Carbocationes?
La idea de los carbocationes no es nueva. Se remonta a finales del siglo XIX.
Primeras Observaciones (1891-1902)
En 1891, un científico llamado G. Merling notó que al calentar una sustancia llamada tropilideno con bromo, obtenía un material cristalino. Años después, otros científicos, Doering y Knox, demostraron que este material era un tipo de carbocatión llamado bromuro de tropilio. Este ion era especial porque se comportaba de una manera que los científicos llaman "aromática", lo que le daba una estabilidad particular.
En 1902, se descubrió que algunas sustancias incoloras, como el trifenilmetanol, se volvían de colores intensos (amarillo o naranja) al mezclarse con ácidos fuertes. Esto se debía a que se formaban carbocationes con carga positiva. Un científico llamado Adolf von Baeyer se dio cuenta de que estos compuestos se comportaban como sales, lo que confirmaba la presencia de iones cargados.
Reconocimiento en Reacciones Químicas (1899-1962)
La idea de que los carbocationes eran intermediarios en muchas reacciones orgánicas fue propuesta por Julius Stiegliz en 1899. Más tarde, en 1922, Hans Meerwein desarrolló esta idea al estudiar ciertas reacciones de reorganización. Se descubrió que los carbocationes también participaban en reacciones importantes como las reacciones SN1 y E1, y en otras reacciones donde las moléculas se reorganizan.
Al principio, la comunidad científica no aceptaba fácilmente la idea de los carbocationes. Incluso algunas revistas científicas importantes, como el Journal de la American Chemical Society, rechazaban artículos que los mencionaban. Sin embargo, con el tiempo y más investigaciones, su existencia se confirmó.
Observación Directa (1962)
Un gran avance ocurrió en 1962, cuando el científico George Olah logró observar directamente un carbocatión llamado tert-butilo usando una técnica especial llamada resonancia magnética nuclear (RMN). Esto fue posible al disolver el carbocatión en un ácido muy fuerte conocido como "ácido mágico". Esta observación directa fue una prueba definitiva de su existencia y ayudó a resolver muchas dudas en la química.
Tipos y Estabilidad de los Carbocationes
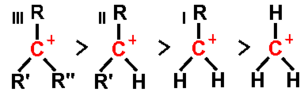
Los carbocationes se clasifican según cuántos átomos de carbono están unidos al carbono que tiene la carga positiva.
¿Cómo se Clasifican los Carbocationes?
- Carbocationes primarios: Tienen uno o ningún átomo de carbono unido al carbono cargado. Son los menos estables.
- Carbocationes secundarios: Tienen dos átomos de carbono unidos al carbono cargado. Son más estables que los primarios.
- Carbocationes terciarios: Tienen tres átomos de carbono unidos al carbono cargado. Son los más estables.
¿Por Qué Algunos Carbocationes son Más Estables?
La estabilidad de un carbocatión aumenta a medida que tiene más grupos de átomos de carbono (llamados grupos alquilo) unidos al carbono con carga. Esto se debe a que estos grupos ayudan a "repartir" la carga positiva, haciendo que el carbocatión sea más estable. Los carbocationes primarios son muy inestables porque no tienen suficientes grupos que los ayuden a estabilizarse.
Por ejemplo, el catión alilo (CH2=CH-CH2+) y el catión bencilo (C6H5-CH2+) son más estables que otros carbocationes primarios. Esto se debe a que tienen un enlace doble carbono-carbono cerca del carbono cargado, lo que les permite estabilizar la carga de una manera especial.
Reacciones y Cambios de los Carbocationes
Los carbocationes son "electrófilos", lo que significa que les "gustan" los electrones y buscan moléculas que tengan electrones disponibles. Por eso, suelen ser el objetivo de ataque de otras moléculas llamadas "nucleófilos", que tienen electrones para compartir, como los iones OH- o los iones de halógeno.
Los carbocationes también pueden sufrir "reordenamientos". Esto significa que pueden cambiar su estructura para volverse más estables. Por ejemplo, un carbocatión menos estable puede reorganizarse rápidamente para formar uno más estable. Este proceso puede complicar la forma en que los químicos fabrican ciertos compuestos.
Algunos carbocationes, como el catión norbornilo, tienen una estructura un poco inusual, con enlaces que se extienden sobre tres átomos de carbono de una manera que no es la clásica. A estos se les llama "iones no clásicos". Hubo mucho debate en la comunidad científica sobre si estos iones existían o no, pero las investigaciones de George Olah ayudaron a confirmar su existencia.
Véase también
 En inglés: Carbocation Facts for Kids
En inglés: Carbocation Facts for Kids
- Carbanión