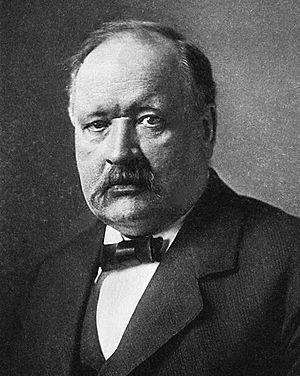Reacción ácido-base para niños
Una reacción ácido-base, también conocida como reacción de neutralización, es un tipo de reacción química muy común. Ocurre cuando un ácido, como el ácido clorhídrico, se mezcla con una base, como el hidróxido de sodio.
Cuando un ácido y una base reaccionan, forman una nueva sustancia llamada sal. Las propiedades de esta sal son diferentes a las del ácido y la base que la crearon. La palabra "sal" se usa para muchos compuestos químicos, no solo la sal de mesa.
Estas reacciones se llaman de "neutralización" porque el ácido y la base "neutralizan" o eliminan las propiedades del otro. Generalmente, estas reacciones liberan energía en forma de calor, lo que significa que son exotérmicas.
Existen diferentes formas de entender cómo funcionan estas reacciones. Por ejemplo, si mezclas un ácido fuerte con una base débil, la base se neutralizará por completo. Si mezclas un ácido fuerte con una base fuerte, la sustancia que esté en mayor cantidad será la que quede en la mezcla.
El primer concepto científico sobre ácidos y bases fue propuesto por el químico francés Antoine Lavoisier alrededor de 1776.
Contenido
¿Qué son los ácidos y las bases?
La idea de Lavoisier
Lavoisier notó que muchos ácidos fuertes que conocía, como el ácido nítrico (HNO3) y el ácido sulfúrico (H2SO4), contenían oxígeno. Por eso, pensó que el oxígeno era esencial para que una sustancia fuera un ácido. De hecho, llamó al oxígeno "formador de ácido".
Sin embargo, más tarde, en 1810, Humphry Davy demostró que algunos ácidos, como el sulfuro de hidrógeno (H2S) y los ácidos hidrácidos (como el HCl), no tenían oxígeno. Esto demostró que la idea de Lavoisier no era del todo correcta.
La idea de Liebig
Alrededor de 1838, Justus von Liebig propuso otra definición. Él dijo que un ácido es una sustancia que contiene hidrógeno y que ese hidrógeno puede ser reemplazado por un metal. Esta idea fue útil por casi 50 años.
La idea de Arrhenius
El químico sueco Svante Arrhenius desarrolló una definición más sencilla y moderna. Por su trabajo, recibió el Premio Nobel de Química en 1903.
Según Arrhenius, un ácido es una sustancia que, cuando se disuelve en agua, libera iones de hidrógeno (H+). Estos iones de hidrógeno se unen rápidamente al agua para formar iones hidronio (H3O+). Una base, por otro lado, es una sustancia que, al disolverse en agua, libera iones hidroxilo (OH−).
Cuando un ácido de Arrhenius y una base de Arrhenius reaccionan, forman agua y una sal. Esto es lo que llamamos una reacción de neutralización.
Por ejemplo, el hidróxido de sodio (una base) y el ácido sulfúrico (un ácido) reaccionan así: <chem>2NaOH + H2SO4 -> Na2SO4 + 2H2O</chem> Aquí se forman sulfato de sodio (una sal) y agua.
La idea de Brønsted-Lowry
En 1923, Johannes Nicolaus Brønsted y Thomas Martin Lowry propusieron una definición más amplia. Su idea se basa en la transferencia de "protones" (que son iones de hidrógeno, H+).
Según Brønsted-Lowry:
- Un ácido es una sustancia que puede donar un protón (H+).
- Una base es una sustancia que puede aceptar un protón (H+).
Cuando un ácido dona un protón, se convierte en su base conjugada. Cuando una base acepta un protón, se convierte en su ácido conjugado.
Por ejemplo, el ácido clorhídrico (HCl) dona un protón y se convierte en el anión cloruro (Cl−), que es su base conjugada: <chem>HCl -> Cl- + H+</chem>
El anión hidróxido (OH−), que es una base, acepta un protón y se convierte en agua (H2O), que es su ácido conjugado: <chem>H+ + OH- -> H2O</chem>
Esta definición es útil porque explica reacciones que no ocurren solo en agua, como la reacción del amoníaco (NH3) con un protón para formar el catión amonio (NH4+): <chem>H+ + NH3 -> NH4+</chem>
El agua misma puede actuar como ácido y como base, donando o aceptando protones.
La idea de Lewis
La definición de Lewis, propuesta por Gilbert N. Lewis también en 1923, es la más general. En lugar de protones, se enfoca en los "pares de electrones".
Según Lewis:
- Una base de Lewis es una sustancia que puede donar un par de electrones.
- Un ácido de Lewis es una sustancia que puede aceptar un par de electrones.
Por ejemplo, en la reacción clásica de ácido clorhídrico con hidróxido de sodio: <chem>HCl(aq) + NaOH(aq) <=> H2O(l) + NaCl(aq)</chem> Lewis ve al ion H+ como el ácido (porque puede aceptar un par de electrones) y al ion OH− como la base (porque puede donar un par de electrones). Al donar el par de electrones, se forma un enlace covalente que crea agua (H2O).
Esta definición es muy útil porque se aplica a muchas reacciones donde no hay transferencia de protones. Por ejemplo, un ion plata (Ag+) actúa como ácido y el amoníaco (NH3) como base: <chem>Ag+ + 2:NH3 <=> [H3N:Ag:NH3]+</chem> Aquí, el amoníaco dona pares de electrones al ion plata.
¿Cómo se usa la neutralización?
Una forma común de usar las reacciones de neutralización es en un proceso llamado "valoración" o "titulación". Imagina que tienes una solución de ácido clorhídrico en un matraz. Le añades unas gotas de un indicador llamado fenolftaleína. Este indicador es incoloro en un medio ácido.
Luego, en un tubo largo y graduado llamado bureta, pones una solución de hidróxido de sodio (una base). Poco a poco, dejas caer la base en el matraz con el ácido. La base reacciona con el ácido, y la cantidad de ácido disminuye, haciendo que el pH de la solución aumente. Es importante agitar el matraz para que todo se mezcle bien.
Cuando todo el ácido ha reaccionado, la siguiente gota de base que añades hace que la solución se vuelva básica. En ese momento, el indicador de fenolftaleína cambia a un color rosa. ¡Eso te dice que todo el ácido ha sido neutralizado!
Este método se puede usar para saber la cantidad exacta de un ácido o una base en una solución. Las reacciones de neutralización ocurren "equivalente a equivalente", lo que significa que una cantidad específica de ácido es neutralizada por una cantidad equivalente de base.
Para calcular las cantidades, se usa una fórmula: Na · Va = Nb · Vb.
- Na es la normalidad (una medida de concentración) del ácido.
- Va es el volumen del ácido.
- Nb es la normalidad de la base.
- Vb es el volumen de la base.
Si conoces tres de estos valores, puedes calcular el cuarto. Por ejemplo, si sabes la concentración y el volumen de la base que usaste, y el volumen del ácido que neutralizaste, puedes calcular la concentración del ácido. Para que los resultados sean más precisos, se repite la valoración varias veces.
Véase también
 En inglés: Acid–base reaction Facts for Kids
En inglés: Acid–base reaction Facts for Kids
- Protonación y deprotonación
- Valoración ácido-base
- Sal (química)
Enlaces externos
Reacción ácido-base, p. 1, en Google Libros