Espectroscopia ultravioleta-visible para niños
La espectroscopia ultravioleta-visible (UV/VIS) es una técnica científica que usa la luz para estudiar diferentes sustancias. Imagina que la luz es como una herramienta especial que nos ayuda a entender de qué están hechas las cosas. Esta técnica utiliza luz de las regiones ultravioleta (UV), visible e infrarroja cercana (NIR) del espectro electromagnético. Esto significa que trabaja con longitudes de onda entre 160 y 780 nanómetros.
Cuando una sustancia absorbe esta luz, sus electrones se "excitan" y cambian de nivel de energía. Al medir cuánta luz absorbe una sustancia y a qué longitudes de onda, los científicos pueden identificar algunos de sus componentes y saber qué tan concentrada está.
Esta técnica se usa mucho en laboratorios de química y bioquímica. Por ejemplo, sirve para encontrar pequeñas cantidades de una sustancia en una mezcla, como rastros de metales en aleaciones o la concentración de un compuesto en el cuerpo.
Contenido
¿Qué es la Espectroscopia UV-Visible?
La espectroscopia UV-visible es una forma de analizar materiales. Se basa en cómo las moléculas de una sustancia interactúan con la luz. Cada sustancia absorbe la luz de una manera única, como si tuviera una "huella dactilar" de luz.
¿Cómo se usa la luz en esta técnica?
La luz es una forma de energía que viaja en ondas. Para entender la espectroscopia, es útil conocer dos conceptos clave de las ondas:
- Longitud de onda: Es la distancia entre dos picos de una onda de luz. Se mide en unidades muy pequeñas, como nanómetros (un nanómetro es una milmillonésima parte de un metro).
- Frecuencia: Es el número de veces que una onda completa un ciclo (un pico y un valle) en un segundo. Se mide en Hertz (Hz).
Cuando una sustancia absorbe luz, los electrones de sus átomos o moléculas saltan a un nivel de energía más alto. Luego, cuando esos electrones regresan a su estado original, pueden liberar esa energía extra en forma de calor o, a veces, como luz. Cuando liberan luz, a esto se le llama luminiscencia.
Tipos de luminiscencia en espectroscopia
Existen diferentes formas en que una sustancia puede emitir luz después de ser excitada:
- Fluorescencia molecular: La luz se emite casi de inmediato.
- Fosforescencia molecular: La luz se emite lentamente, incluso después de que la fuente de luz original se apaga.
- Quimioluminiscencia: La luz se produce por una reacción química.
Principio de la Absorción de Luz
El corazón de la espectroscopia UV-visible es la absorción de luz. Cuando una molécula absorbe luz ultravioleta o visible, uno de sus electrones se mueve de un estado de baja energía (llamado estado basal) a un estado de mayor energía (llamado estado excitado). La energía extra que no se usa para excitar el electrón se libera como calor.
¿Por qué algunas sustancias tienen color?
Una diferencia notable entre algunas sustancias es su color. Por ejemplo, la quinona es amarilla, y la clorofila es verde. El color se debe a que estas sustancias absorben ciertas longitudes de onda de la luz visible y reflejan o transmiten otras. Las que no son absorbidas son las que vemos.
Ciertos enlaces químicos, como los enlaces dobles, pueden hacer que las moléculas absorban energía tanto en la región visible como en la UV. Un ejemplo es el betacaroteno, que le da el color naranja a las zanahorias.
La Ley de Beer-Lambert
Cuando un rayo de luz UV-visible atraviesa una solución que contiene una sustancia que absorbe luz, la intensidad de la luz disminuye. Esta disminución se mide con la Ley de Beer-Lambert. Esta ley nos dice que la cantidad de luz absorbida por una solución es directamente proporcional a la concentración de la sustancia que absorbe y a la distancia que la luz viaja a través de la solución.
La ley se puede expresar con una fórmula:

Donde:
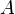 es la absorbancia (cuánta luz se absorbe).
es la absorbancia (cuánta luz se absorbe). es el coeficiente de extinción (una característica de cada sustancia).
es el coeficiente de extinción (una característica de cada sustancia).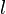 es la longitud del camino que la luz recorre en la muestra (en centímetros).
es la longitud del camino que la luz recorre en la muestra (en centímetros).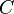 es la concentración de la sustancia en la solución (en moles por litro).
es la concentración de la sustancia en la solución (en moles por litro).
Esta ley es muy importante porque permite a los científicos calcular la concentración de una sustancia desconocida en una solución, midiendo cuánta luz absorbe.
¿Cómo funcionan las transiciones electrónicas?
Cuando un fotón (una partícula de luz) con la energía adecuada choca con una molécula, un electrón salta de su nivel de energía normal (estado fundamental) a un nivel de energía más alto (estado excitado). En la espectroscopia UV-visible, podemos observar diferentes tipos de estos "saltos" electrónicos:
Transiciones sigma (σ) a sigma estrella (σ*)
Estas transiciones ocurren en moléculas que solo tienen enlaces simples, como los hidrocarburos (compuestos de carbono e hidrógeno). Requieren mucha energía, por lo que se observan en la región ultravioleta de vacío del espectro.
Transiciones n a sigma estrella (σ*)
Se dan en moléculas que tienen átomos con pares de electrones no compartidos (como oxígeno, nitrógeno o cloro). La energía necesaria es alta, pero menor que en las transiciones σ→σ*. Se ven en la región UV lejana.
Transiciones n a pi estrella (π*) y pi (π) a pi estrella (π*)
Estas son las transiciones más comunes en la espectroscopia UV-visible. Ocurren en moléculas con enlaces dobles o triples (llamados grupos cromóforos). Las transiciones π→π* requieren energía media y se ven en la región UV. Las transiciones n→π* requieren menos energía y se observan en la región visible del espectro, lo que a menudo da color a las sustancias.
El espectrómetro UV-visible registra las longitudes de onda donde ocurre la absorción y mide la cantidad de luz absorbida. El resultado es un gráfico llamado espectro, que muestra la absorbancia frente a la longitud de onda.
El Espectrofotómetro UV-Visible
Un espectrofotómetro es el instrumento que se usa para realizar la espectroscopia UV-visible. Permite comparar la luz absorbida o transmitida por una solución con una cantidad desconocida de una sustancia, con una solución que tiene una cantidad conocida de la misma sustancia.
¿Cómo funciona un espectrofotómetro?
- Las muestras se colocan en pequeñas celdas especiales, generalmente de cuarzo o vidrio.
- El aparato usa dos tipos de lámparas: una de hidrógeno o deuterio para la luz UV, y una de tungsteno o halógeno para la luz visible.
- También se usa una celda de referencia que solo contiene el solvente (el líquido donde está disuelta la muestra).
- La luz pasa al mismo tiempo por la celda de la muestra y por la celda de referencia.
- El espectrofotómetro compara la luz que atraviesa la muestra con la que atraviesa la referencia.
- Un detector mide la luz que pasa y el instrumento crea el espectro de absorción al escanear diferentes longitudes de onda.
Tipos de espectrofotómetros
- Espectrofotómetro de doble haz: Tiene dos compartimentos para las celdas. Esto le permite medir al mismo tiempo la luz absorbida por la muestra y por la referencia, lo que lo hace muy preciso.
- Espectrofotómetro de haz simple: Solo tiene un compartimento. Primero se mide la referencia para establecer un "cero", y luego se mide la muestra.
Usos y Consideraciones Generales
La espectroscopia UV-visible es muy útil para analizar compuestos que tienen grupos cromóforos. Un cromóforo es cualquier grupo de átomos en una molécula que absorbe luz, y es lo que a menudo le da color a una sustancia.
Esta técnica es especialmente buena para analizar compuestos aromáticos (moléculas con anillos especiales de átomos) y ciertos ácidos.
Espectroscopia de Reflectancia Difusa (DRIFTS)
Una variante de esta técnica es la espectroscopia de reflectancia difusa. Se usa cuando la luz no atraviesa la muestra, sino que se refleja en todas direcciones. Esto es útil para analizar materiales que no son transparentes, como polvos.
Ventajas de DRIFTS
- Requiere muy poca preparación de la muestra.
- Permite analizar la mayoría de los materiales que no reflejan la luz, incluso los muy opacos.
- Es útil para analizar superficies irregulares y materiales duros.
- Tiene una alta sensibilidad, pudiendo detectar cantidades muy pequeñas de sustancias.
Desventajas de DRIFTS
- Se limita principalmente a muestras en polvo.
- Si la muestra contiene agua, el calor de la luz infrarroja puede evaporarla, causando interferencias en el espectro.
- La forma en que se llena la celda con la muestra puede afectar la reproducibilidad de los resultados, especialmente en análisis cuantitativos.
Véase también



 En inglés:
En inglés: