Fibrosis quística para niños
Datos para niños Fibrosis quística |
||
|---|---|---|
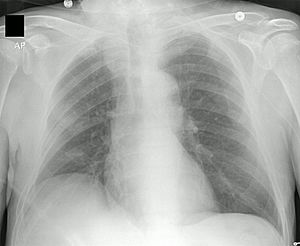
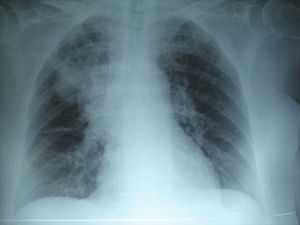 Neumonía apical derecha: en la FQ, la infección crónica da lugar a la destrucción del parénquima pulmonar, ocasionando por último la muerte por insuficiencia respiratoria.
|
||
| Especialidad | genética médica pediatría neumología |
|
| Síntomas | Dificultad para respirar, tos con mucosidad, crecimiento deficiente, heces grasosas. | |
| Diagnóstico | Prueba del sudor, pruebas genéticas | |
| Tratamiento |
|
|
| Sinónimos | ||
| Mucoviscidosis. Fibrosis quística del páncreas. | ||
La fibrosis quística (abreviada FQ) es una enfermedad genética que se hereda de forma autosómica recesiva. Esto significa que una persona debe heredar dos copias del gen afectado (una de cada padre) para desarrollar la enfermedad. Afecta principalmente a los pulmones, pero también puede influir en el páncreas, hígado e intestino. La FQ provoca que el cuerpo produzca un moco muy espeso y pegajoso que se acumula en estos órganos.
Esta enfermedad es una de las afecciones pulmonares crónicas más comunes en niños y jóvenes. Puede ser grave, y los pacientes a menudo enfrentan infecciones pulmonares repetidas.
La FQ es causada por un cambio (llamado mutación) en un gen específico. Este gen es el encargado de fabricar una proteína llamada "reguladora de la conductancia transmembrana de la fibrosis quística" (CFTR). Esta proteína es importante para que el ion cloro se mueva correctamente a través de las membranas de las células. Cuando la proteína CFTR no funciona bien, se altera la producción de sudor, jugos digestivos y moco. Se han descubierto más de 1500 mutaciones diferentes que pueden causar esta enfermedad.
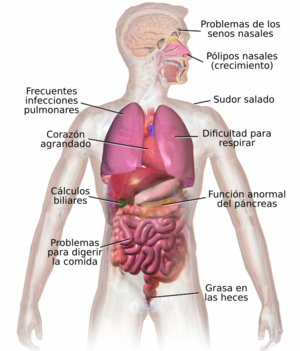
La FQ afecta a varios órganos y sistemas del cuerpo, haciendo que las glándulas produzcan secreciones anormalmente espesas. El problema más grave suele ser en los pulmones, causando el 95% de los fallecimientos. Esto se debe a infecciones repetidas que ocurren porque el moco espeso bloquea los bronquios.
Es una de las enfermedades genéticas más comunes en personas de ascendencia europea. Se estima que aproximadamente 1 de cada 5000 bebés nacidos en esta población tiene FQ. Además, se calcula que 1 de cada 25 personas de ascendencia europea es portadora de una copia del gen que no funciona correctamente, sin tener la enfermedad.
El nombre "fibrosis quística" se refiere a dos características observadas en el páncreas: la cicatrización (fibrosis) y la formación de quistes. Estas características fueron identificadas por primera vez en la década de 1930. También se le conoce como mucoviscidosis, que significa "moco pegajoso".
Las personas con FQ tienen una alta concentración de sal (cloruro de sodio) en su sudor. Esta característica es clave para el diagnóstico, que se realiza mediante una prueba de sudor. También se pueden usar pruebas genéticas para confirmar la enfermedad.
Actualmente no existe una cura para la fibrosis quística. Sin embargo, hay tratamientos que ayudan a mejorar los síntomas y a prolongar la vida de los pacientes. En casos muy graves, cuando los pulmones están muy dañados, puede ser necesario un trasplante de pulmón. La esperanza de vida promedio para estos pacientes a nivel mundial es de unos 35 años, pero en países con sistemas de salud avanzados, como Canadá, la esperanza de vida promedio era de 48 años en 2010.
Contenido
¿Cómo se manifiesta la fibrosis quística?
Los síntomas de la fibrosis quística pueden variar según la edad de la persona, qué órganos están más afectados, los tratamientos que ha recibido y el tipo de infecciones que tenga. Esta enfermedad afecta a todo el cuerpo y puede influir en el crecimiento, la respiración y la digestión.
Síntomas en bebés y niños pequeños
En los recién nacidos, la FQ puede manifestarse con un bajo aumento de peso y una obstrucción intestinal. Esta obstrucción es causada por heces muy densas y voluminosas. Más adelante, durante la niñez y la adolescencia, pueden aparecer otros síntomas. Estos incluyen un retraso en el crecimiento, el desarrollo de problemas pulmonares y dificultades para absorber vitaminas y nutrientes del sistema digestivo.
A la mayoría de los niños se les diagnostica fibrosis quística antes de cumplir un año. En esta etapa, el moco pegajoso empieza a afectar los pulmones y el páncreas. En el sistema respiratorio, estas secreciones espesas son un lugar ideal para que crezcan bacterias. Esto lleva a infecciones crónicas que dañan progresivamente los pulmones. A medida que la condición pulmonar empeora, los pacientes pueden desarrollar hipertensión pulmonar (presión alta en las arterias de los pulmones). En el páncreas, el moco bloquea el paso de las enzimas digestivas hacia el intestino, impidiendo que los alimentos se digieran y absorban correctamente.
Problemas pulmonares y de los senos nasales
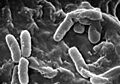
La enfermedad pulmonar en la FQ ocurre porque el moco espeso bloquea las vías respiratorias más pequeñas. La inflamación y las infecciones dañan los pulmones y cambian su estructura, lo que lleva a varios síntomas. Al principio, es común tener tos persistente, producir mucha flema y sentir que la capacidad para hacer ejercicio disminuye. Muchos de estos síntomas aparecen cuando ciertas bacterias, como Pseudomonas aeruginosa, que viven en el moco espeso, crecen sin control y causan neumonía. En etapas avanzadas, los cambios en la estructura del pulmón provocan dificultades respiratorias crónicas.
Otros síntomas incluyen toser sangre o esputo con sangre, dilatación crónica de los bronquios (bronquiectasia), presión arterial alta en los pulmones, insuficiencia cardíaca, sensación de falta de oxígeno (disnea), insuficiencia respiratoria y atelectasia (colapso de una parte del pulmón). A veces, se necesita ayuda para respirar con un ventilador. Además de las infecciones bacterianas, las personas con FQ pueden desarrollar otras enfermedades respiratorias. Un ejemplo es la aspergilosis broncopulmonar alérgica, una reacción exagerada a un hongo común llamado Aspergillus (Aspergillus fumigatus), que empeora los problemas respiratorios. Otra infección es la causada por el complejo Mycobacterium avium (MAC), bacterias relacionadas con la tuberculosis, que pueden dañar gravemente el pulmón y no responden a los antibióticos comunes.
El moco en los senos paranasales también es denso y pegajoso. Puede bloquear los orificios por donde los senos normalmente drenan, haciendo que las secreciones se acumulen y sirvan de caldo de cultivo para bacterias. Esto puede causar dolor facial, fiebre, mucha secreción nasal y cefaleas (dolores de cabeza). Las personas con FQ a menudo desarrollan crecimientos de tejido en la nariz (pólipos) debido a la inflamación por infecciones crónicas en los senos. Estos pólipos pueden empeorar la obstrucción de las vías respiratorias superiores y dificultar aún más la respiración.
Problemas digestivos, hepáticos y pancreáticos
Antes de que existieran las pruebas de detección de FQ en bebés, la enfermedad a menudo se descubría porque el recién nacido no podía expulsar sus primeras heces (meconio). El meconio puede bloquear completamente los intestinos y causar problemas graves. Esta condición, llamada íleo meconial, ocurre en el 10% de los recién nacidos con FQ. También es común que la FQ se asocie con la salida de las membranas internas del recto (prolapso rectal). Esto se debe al mayor volumen de las heces, la mala nutrición y el aumento de la presión en el abdomen por la tos crónica.
El moco pegajoso que se ve en los pulmones también afecta al páncreas. Este órgano produce jugos digestivos que ayudan a descomponer los alimentos. Las secreciones espesas impiden que estas enzimas pancreáticas lleguen al intestino, lo que causa un daño irreversible en el páncreas y a menudo una pancreatitis (inflamación dolorosa). La falta de enzimas digestivas impide que el cuerpo absorba los nutrientes, que luego se eliminan en las heces. Esto se conoce como malabsorción. La malabsorción lleva a la desnutrición y al retraso en el crecimiento, ya que el cuerpo no recibe suficientes calorías. Las personas con FQ tienen problemas especiales para absorber las vitaminas A, D, E y K. Además de los problemas pancreáticos, suelen tener acidez crónica, boca seca (xerostomía), obstrucción intestinal y estreñimiento. Los pacientes mayores también pueden desarrollar el síndrome de obstrucción intestinal distal, causado por heces pegajosas.
Estas secreciones espesas también pueden causar problemas en el hígado. La bilis, que el hígado produce para ayudar a la digestión, puede bloquear las vías biliares, dañando los tejidos cercanos. Con el tiempo, esto puede llevar a la cirrosis. En este caso, funciones importantes del hígado, como la eliminación de toxinas y la producción de proteínas esenciales (por ejemplo, los factores de coagulación para la coagulación sanguínea), se ven afectadas.
Problemas hormonales y de crecimiento
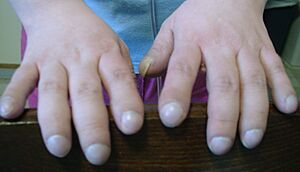
El páncreas contiene unas células llamadas islotes de Langerhans, que producen insulina. La insulina es una hormona que ayuda a controlar los niveles de glucosa (azúcar) en la sangre. Si el páncreas se daña, estas células pueden perderse, lo que puede llevar a la diabetes. Además, la vitamina D, que se obtiene de los alimentos, es importante para regular el calcio y el fósforo en el cuerpo. Si no se absorbe suficiente vitamina D, puede ocurrir osteoporosis, lo que aumenta el riesgo de fracturas. Las personas con FQ a menudo tienen una malformación en los dedos de manos y pies, conocida como "dedos en palillo de tambor". Esto se debe a los efectos de la enfermedad crónica y a la falta de oxígeno en sus huesos.
El retraso en el crecimiento es una característica importante de esta enfermedad. Los niños con FQ generalmente no ganan peso ni altura al mismo ritmo que otros niños de su edad. A menudo, se les diagnostica la enfermedad cuando se investigan las causas de este retraso. Las razones del retraso en el crecimiento son varias: infecciones pulmonares crónicas, mala absorción de nutrientes en el sistema digestivo y un aumento de las necesidades de energía del cuerpo debido a la enfermedad crónica.
¿Cómo se diagnostica la fibrosis quística?
La fibrosis quística se puede diagnosticar mediante pruebas en recién nacidos, un examen de electrolitos en el sudor o una prueba genética. En 2006, en Estados Unidos, el 10% de los casos se detectaban poco después del nacimiento (idealmente antes del quinto día de vida) como parte de programas de detección neonatal. Estos programas buscan niveles elevados de una enzima llamada tripsina (prueba TIR). Si la prueba es positiva, se repite más tarde para confirmar. Sin embargo, en la mayoría de los países, estas pruebas no se hacen de forma rutinaria. Por eso, a menudo se diagnostica la enfermedad cuando los síntomas ya son evidentes.
La prueba de diagnóstico más común es el examen del sudor, desarrollado en 1959. Se usa un medicamento llamado pilocarpina para estimular la sudoración en una pequeña área de la piel. Luego, se recolecta una muestra de sudor y se mide la cantidad de sodio y cloruro. Las personas con FQ tienen niveles más altos de estos iones en el sudor. Una vez que la prueba del sudor es positiva, se realiza un diagnóstico más preciso identificando las mutaciones en el gen CFTR.
Existen otras pruebas para identificar posibles complicaciones y seguir la evolución de la enfermedad. Las imágenes de rayos X y TAC ayudan a detectar signos de daño o infección en los pulmones. El cultivo de esputo (moco) se examina con un microscopio para identificar las bacterias responsables y elegir los antibióticos más efectivos. Las pruebas de función pulmonar miden la capacidad de los pulmones y la rapidez con la que el aire puede moverse. Esto ayuda a decidir si se necesita un tratamiento con antibióticos o a evaluar su eficacia. Los análisis de sangre pueden detectar problemas hepáticos, deficiencias de vitaminas y la aparición de diabetes. Las pruebas DEXA o DXA se usan para detectar la osteoporosis.
Diagnóstico genético
El diagnóstico genético de la FQ es complejo porque se han descrito más de 1800 mutaciones diferentes, la mayoría de ellas pequeñas. Estas mutaciones se agrupan según cómo afectan al gen y a la enfermedad. La frecuencia de estas mutaciones varía en cada población, por lo que las pruebas deben adaptarse. Sin embargo, la mutación más común en la mayoría de las poblaciones es la deleción ΔF508.
Hoy en día, a los bebés se les puede hacer un diagnóstico genético al nacer mediante la secuenciación del gen CFTR para saber si tienen la enfermedad. Cuanto antes se inicia el tratamiento, mejor es la calidad de vida y mayor la esperanza de vida.
Diagnóstico antes del nacimiento
Las parejas que esperan un bebé o planean tenerlo pueden hacerse pruebas para buscar mutaciones en el gen CFTR. Esto ayuda a saber las probabilidades de que su hijo nazca con fibrosis quística. La prueba generalmente se hace en uno o ambos padres. Si se detecta un riesgo alto de FQ, también se puede hacer la prueba en el feto. El objetivo principal de estas pruebas es permitir una planificación adecuada del cuidado del bebé y prepararse para los tratamientos necesarios desde el nacimiento.
Como el desarrollo de la FQ en el feto requiere que cada padre transmita una copia del gen CFTR mutado, y las pruebas pueden ser costosas, a menudo se empieza examinando a uno de los padres. Si este resulta ser portador de una mutación, se examina al otro para determinar el riesgo. No es posible analizar todas las más de mil mutaciones conocidas. Las pruebas suelen buscar las mutaciones más comunes, como la ΔF508. Si se sabe que una familia tiene una mutación poco común, se puede buscar específicamente. Un resultado negativo no garantiza que el niño no tendrá la enfermedad, ya que no todas las mutaciones conocidas son detectadas por las pruebas estándar.
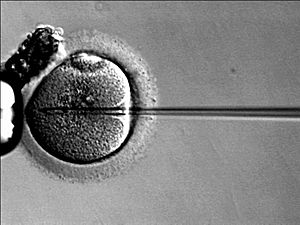
Las parejas en riesgo a menudo realizan pruebas adicionales durante el embarazo o antes. La fecundación in vitro con diagnóstico genético preimplantacional permite examinar el embrión antes de colocarlo en el útero. Esta prueba se realiza tres días después de la fecundación para detectar genes CFTR anormales. Si se identifican dos genes CFTR mutados en un embrión, este no se transfiere, y se implanta otro con al menos un gen normal.
Durante el embarazo, se pueden realizar pruebas en la placenta (muestra de vellosidad coriónica) o en el líquido amniótico que rodea al feto (amniocentesis), con la ayuda del ultrasonido. Sin embargo, estas pruebas tienen un pequeño riesgo, por lo que es importante evaluar los beneficios antes de realizarlas.
¿Cómo se trata la fibrosis quística?
Un aspecto clave en el tratamiento de la fibrosis quística es controlar y tratar el daño pulmonar causado por el moco espeso y las infecciones. El objetivo es mejorar la calidad de vida del paciente. Para las infecciones crónicas y agudas, se administran antibióticos por vías intravenosa, inhalatoria y oral. También se usan dispositivos mecánicos y medicamentos (en forma de inhaladores) para controlar las secreciones y así descongestionar las vías respiratorias. Otros tratamientos incluyen la insulina para la diabetes y el reemplazo de enzimas para los problemas pancreáticos. Además, se investigan procedimientos como el trasplante y la terapia génica para abordar algunos de los efectos de la enfermedad.
Una dieta saludable, ejercicio regular y tratamientos intensivos con antibióticos están ayudando a aumentar la esperanza de vida de las personas con FQ.
Antibióticos para los pulmones
Los antibióticos se recetan cuando hay sospecha de neumonía o un empeoramiento de la función pulmonar. Se eligen según el historial de infecciones del paciente. Muchas bacterias comunes en la fibrosis quística son resistentes a varios antibióticos y requieren semanas de tratamiento intravenoso con medicamentos como vancomicina, tobramicina, meropenem, ciprofloxacina y piperacilina.
A menudo, la terapia prolongada requiere hospitalización y la colocación de una vía intravenosa permanente, como un catéter central insertado percutáneamente (PICC). También es común usar antibióticos inhalados, como tobramicina, colistina y gentamicina, durante varios meses para mejorar la función pulmonar y evitar que las bacterias se multipliquen. Algunos antibióticos orales, como la ciprofloxacina o la azitromicina, se usan a veces para prevenir o controlar infecciones. En algunos casos, pasan años entre hospitalizaciones, mientras que en otros se necesita internación cada año.
En tratamientos prolongados, algunos antibióticos comunes (como tobramicina y vancomicina) pueden causar pérdida de audición o problemas en los riñones. Para prevenir estos efectos secundarios, se miden las concentraciones de estos medicamentos en la sangre y se ajusta la dosis si es necesario.
Otros tratamientos para los pulmones
Existen varias técnicas para hacer el esputo (moco) más fluido y facilitar su expulsión. En el hospital, se usa la fisioterapia; un terapeuta realiza presiones y palmoteos en el pecho varias veces al día. Hay dispositivos mecánicos portátiles que funcionan de manera similar, como el ventilador de alta frecuencia oscilatoria y los aparatos de ventilación percusiva intrapulmonar, que se pueden usar en casa. El ejercicio aeróbico es muy beneficioso para las personas con fibrosis quística, ya que ayuda a descongestionar el esputo y mejora la salud cardiovascular y el bienestar general.
Entre las sustancias inhaladas que ayudan a fluidificar las secreciones y facilitar su expulsión están la dornasa alfa y la solución salina hipertónica. La dornasa alfa es una enzima que descompone el ADN en el esputo, reduciendo su viscosidad. La N-acetilcisteína también fluidifica el esputo, pero sus beneficios son menos significativos. Además, se usan broncodilatadores como el salbutamol y el salmeterol para ensanchar las vías respiratorias pequeñas, relajando los músculos de los bronquios.
Si la condición pulmonar empeora, puede ser necesario un soporte respiratorio mecánico. Por las noches, algunos pacientes usan máscaras especiales que empujan el aire a los pulmones. La ventilación no invasiva con máscara nasal y presión positiva (VPAP) ayuda a prevenir caídas significativas en los niveles de oxígeno en sangre durante el sueño. También se puede usar en la fisioterapia respiratoria para ayudar a expulsar el esputo. Sin embargo, en casos graves, puede ser necesaria una asistencia respiratoria más invasiva, como la intubación (colocación de un tubo en la tráquea).
Tratamiento de otros problemas de la FQ
Los recién nacidos con íleo meconial suelen necesitar cirugía. En adultos con síndrome de obstrucción intestinal distal, esto no es tan común. El tratamiento para la insuficiencia pancreática consiste en reemplazar las enzimas digestivas que faltan. Esto permite que los intestinos absorban correctamente los nutrientes y vitaminas que, de otro modo, se perderían en las heces. Aun así, la mayoría de las personas con FQ necesitan dosis adicionales de vitaminas A, D, E y K en forma de suplementos, y deben seguir una dieta rica en calorías. La diabetes que a menudo acompaña a la FQ se trata con inyecciones de insulina. La osteoporosis se puede prevenir con suplementos de vitamina D y calcio, y a menudo se trata con bifosfonatos. Para el retraso en el crecimiento, se puede insertar un tubo de alimentación (gastrostomía) para aumentar la ingesta de calorías, y también se administran inyecciones de hormona de crecimiento.
Las infecciones de los senos paranasales suelen tratarse con un largo ciclo de antibióticos. El desarrollo de pólipos y otros cambios en las vías nasales puede restringir el flujo de aire. Por eso, a menudo se realiza cirugía para aliviar la obstrucción y limitar nuevas infecciones. También se usan corticosteroides nasales, como la fluticasona, para reducir la inflamación.
Trasplante y terapias avanzadas
Generalmente, se considera el trasplante de pulmón en personas con un deterioro progresivo de la función pulmonar y una fatiga creciente. Aunque en otras enfermedades se puede trasplantar un solo pulmón, en pacientes con FQ se deben reemplazar ambos. Esto se debe a que las bacterias en el pulmón restante podrían infectar el órgano trasplantado. También se puede realizar un trasplante de páncreas o hígado al mismo tiempo para tratar la enfermedad hepática o la diabetes. La opción del trasplante de pulmón se evalúa cuando la función pulmonar está tan afectada que la vida del paciente está en riesgo o necesita ayuda mecánica para respirar.
La terapia génica es una promesa en la lucha contra la enfermedad. Con esta técnica, se intenta insertar una copia normal del gen CFTR en las células afectadas. Se han realizado estudios para insertar genes en adenovirus. Actualmente, estos virus se usan en ensayos donde el gen CFTR normal se administra en forma de aerosol a las células que recubren los pulmones (terapia génica in vivo). Se espera que los adenovirus inserten el gen normal, haciendo que los canales de cloro en estas células funcionen correctamente.
Algunos estudios sugieren que para prevenir los problemas pulmonares de la fibrosis quística, solo se necesita que entre el 5% y el 10% de la proteína CFTR funcione normalmente. Un inconveniente de los adenovirus es que no se integran en el ADN de la célula huésped. Por lo tanto, se pierden con el tiempo, lo que significa que la expresión del gen es temporal y se necesita reintroducir el vector. Se han propuesto varios enfoques y se han iniciado muchos estudios clínicos, pero aún hay obstáculos que superar para que la terapia génica sea exitosa.
Otro enfoque para tratar la fibrosis quística es el uso de medicamentos que mejoran o "modulan" la proteína CFTR, corrigiendo el problema subyacente en su producción. Hay varios de estos medicamentos en investigación, como Ivacaftor, Lumacaftor y Tezacaftor. El medicamento Ivacaftor (conocido como Kalydeco) fue aprobado inicialmente para pacientes mayores de 6 años y, a partir de 2015, para pacientes de 2 a 5 años. Está autorizado para tratar la mutación G551D, que afecta a menos del 3% de los pacientes con FQ. En 2014, fue autorizado para otras mutaciones específicas. Este modulador puede mejorar la calidad de vida de los pacientes, ayudando a ganar peso y mejorando la salud pulmonar, lo que reduce la probabilidad de infecciones. El costo de esta terapia era alto en 2014.
La combinación de lumacaftor/ivacaftor (conocida como Orkambi) ha sido aprobada para pacientes con la mutación ΔF508 (la forma más común) en su forma homocigota (cuando tienen dos copias iguales de la mutación). También se está investigando la combinación de ivacaftor/tezacaftor (conocida como Symkevi) para pacientes con la mutación ΔF508 en su forma heterocigota (una copia diferente en cada gen).
La combinación Elexacaftor-tezacaftor-ivacaftor ha demostrado ser efectiva en pacientes con fibrosis quística que tenían genotipos de función mínima y en quienes los tratamientos moduladores anteriores no funcionaron.
Para las mutaciones donde la producción de la proteína se detiene antes de tiempo, se están probando medicamentos que intentan que las células completen la proteína CFTR. Se realizaron ensayos clínicos con el medicamento talureno, pero los resultados no fueron concluyentes para la mayoría de los pacientes, aunque sí prometedores en aquellos que no recibían tratamiento crónico con antibióticos. En 2017, se detuvieron los estudios de este medicamento por falta de eficacia general.
Otros tipos de medicamentos buscan abrir canales alternativos para el cloro en la célula, pero están en etapas más tempranas de investigación.
Actualmente, se han logrado crear modelos animales de la enfermedad mediante la edición y modificación genética, con éxito especial en cerdos y hurónes.
¿Qué tan común es la fibrosis quística?
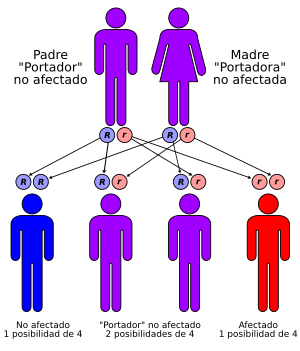
Entre las personas de ascendencia europea, la fibrosis quística es la enfermedad genética recesiva más común que puede ser grave. En Estados Unidos, aproximadamente 30,000 personas tienen FQ, y la mayoría son diagnosticadas a los seis meses de edad. Canadá tiene cerca de 3000 habitantes con esta condición. Se estima que 1 de cada 25 personas de ascendencia europea y 1 de cada 29 personas de ascendencia askenazí son portadoras de una mutación de fibrosis quística. Aunque es menos común en otros grupos, aproximadamente 1 de cada 46 hispanoamericanos, 1 de cada 65 africanos y 1 de cada 90 asiáticos son portadores de al menos un gen CFTR anormal. Argentina y Uruguay tienen una incidencia de casos más alta que el promedio en América Latina, similar a la de Estados Unidos o Canadá.
La fibrosis quística se diagnostica tanto en hombres como en mujeres. Por razones que aún se están investigando, la esperanza de vida al nacer tiende a ser mayor en los hombres afectados que en las mujeres. Este indicador varía principalmente según la calidad de la atención médica. En 1959, la supervivencia promedio de los niños con FQ era de 6 meses. Para los nacidos en 2006 en Estados Unidos, este valor subió a 36.8 años, según datos de la Fundación de la Fibrosis Quística. La esperanza de vida ha mejorado de manera similar en gran parte de Occidente, excepto en países menos desarrollados, donde las cifras son mucho menores y la mayoría de las personas afectadas no sobreviven más allá de los diez años.
La Fundación de la Fibrosis Quística también recopila información sobre el estilo de vida de los adultos estadounidenses con FQ. En 2004, el 91% de esta población había completado la escuela secundaria, y el 54% había asistido a alguna forma de educación universitaria. En cuanto al empleo, el 12.6% de estos adultos no podía trabajar, y el 9.9% estaba desempleado. En cuanto al estado civil, el 59% eran solteros y el 36% estaban casados o vivían en pareja.
¿Por qué la FQ es tan común?
Se cree que la mutación ΔF508 podría tener hasta 52,000 años de antigüedad. Se han propuesto varias ideas para explicar por qué una mutación que causa una enfermedad grave ha persistido y se ha extendido en la población humana. Algunas enfermedades genéticas recesivas comunes, como la anemia de células falciformes, protegen a sus portadores de otras afecciones. Esto se conoce como "ventaja heterocigota". Se ha sugerido que los portadores de genes CFTR mutados podrían haber tenido resistencia al cólera y a otras causas de diarrea, ya que la toxina del cólera necesita proteínas CFTR normales para funcionar. Sin embargo, estudios posteriores no han confirmado esta idea.
La presencia de proteínas CFTR normales es necesaria para que la bacteria Salmonella typhi (que causa la fiebre tifoidea) entre en las células. Esto sugiere que los portadores de genes CFTR mutados podrían ser resistentes a la fiebre tifoidea. Sin embargo, ningún estudio en personas ha confirmado esta hipótesis. En cualquier caso, la baja incidencia de fibrosis quística fuera de Europa, en lugares donde tanto el cólera como la fiebre tifoidea son comunes, aún no tiene una explicación clara.
Historia de la fibrosis quística

Aunque la FQ no fue reconocida completamente hasta la década de 1930, algunos de sus aspectos ya se habían identificado mucho antes. Carl von Rokitansky describió un caso de muerte fetal con peritonitis meconial, una complicación del íleo meconial asociado con la fibrosis quística. El íleo meconial fue descrito por primera vez en 1905 por Karl Landsteiner.
En 1938, Dorothy Andersen publicó un artículo importante. Fue la primera investigadora en definir esta enfermedad (llamada entonces "fibrosis quística del páncreas") y en relacionarla con los problemas pulmonares e intestinales. También propuso que era una enfermedad recesiva y usó el reemplazo de enzimas pancreáticas como tratamiento para los niños afectados. En 1952, Paul di Sant' Agnese descubrió anomalías en los electrolitos del sudor. Basándose en esto, se desarrolló y mejoró la prueba del sudor en la década siguiente.
En 1985, investigadores de Londres, Toronto y Salt Lake City (Utah) localizaron el gen CFTR en el cromosoma 7q. Cuatro años después, en 1989, Francis Collins, Lap-Chee Tsui y John R. Riordan descubrieron la primera mutación de la FQ, la ΔF508, en ese cromosoma. Investigaciones posteriores identificaron más de mil mutaciones diferentes que causan la enfermedad. Lap-Chee Tsui lideró el equipo que descubrió el gen responsable de la FQ. Este fue uno de los primeros trastornos genéticos descubiertos usando un método llamado "genética inversa". Como las mutaciones del gen CFTR son generalmente pequeñas, las técnicas de la genética clásica no podían identificar el gen mutado con precisión. Usando marcadores de proteínas, los estudios genéticos lograron ubicar la mutación en el cromosoma 7. Luego, técnicas avanzadas ayudaron a identificar y secuenciar el gen. Este gen fue uno de los primeros en ser localizado y secuenciado de esta manera, y algunos de los científicos involucrados, como Francis Collins, participaron más tarde en el Proyecto Genoma Humano.
Identificar la mutación específica de la FQ en un paciente puede ayudar a predecir cómo evolucionará la enfermedad. Por ejemplo, los pacientes con dos copias de la mutación ΔF508 casi siempre tienen problemas pancreáticos y suelen tener problemas respiratorios más graves. Sin embargo, hay excepciones, lo que sugiere que otros factores (quizás otros genes) también influyen en cómo se manifiesta la enfermedad. Además, la clonación del gen de la FQ ha abierto la puerta a la terapia génica, como se mencionó antes.
Galería de imágenes
-
Micrografía electrónica de barrido de la bacteria Pseudomonas aeruginosa, asociada con frecuencia a las infecciones pulmonares graves que complican la FQ.
Véase también
 En inglés: Cystic fibrosis Facts for Kids
En inglés: Cystic fibrosis Facts for Kids