Proyecto Genoma Humano para niños
El Proyecto Genoma Humano (PGH) fue un gran esfuerzo internacional de investigación científica. Su objetivo principal era descubrir la secuencia completa de las "letras" químicas que forman nuestro ADN. También buscaba identificar y ubicar todos los genes en el genoma humano promedio, tanto los que dan instrucciones para crear proteínas como los que no.
En 2003, se logró completar la secuencia del genoma humano, aunque todavía se sigue investigando la función de todas sus partes.
Este proyecto, que costó unos 3000 millones de dólares, comenzó en 1990 en Estados Unidos. Fue dirigido por el doctor Francis Collins y contó con la colaboración de muchos científicos de diferentes países. Se esperaba que durara 15 años, pero gracias a la cooperación internacional y a los avances en tecnología, se terminó antes de lo previsto. Un primer borrador se anunció en el año 2000, y el genoma completo se presentó en abril de 2003. Gran parte del trabajo de secuenciación se realizó en universidades y centros de investigación de Estados Unidos, Canadá, Nueva Zelanda, Reino Unido y España.
Conocer la secuencia completa del genoma humano es muy importante para la medicina y la genética. Ayuda a entender mejor enfermedades poco estudiadas, a desarrollar nuevas medicinas y a crear diagnósticos más rápidos y precisos.
El Proyecto Genoma Humano tiene una continuación llamada Proyecto Microbioma Humano. Este proyecto busca estudiar las comunidades de microbios que viven en diferentes partes del cuerpo humano. El objetivo es ver cómo los cambios en estos microbios pueden afectar nuestra salud. Algunos científicos consideran al microbioma como el último "órgano" humano por investigar.
Contenido
Historia del Proyecto Genoma Humano
¿Cómo empezó el Proyecto Genoma Humano?
Las actividades del Proyecto Genoma Humano comenzaron en 1984. En ese tiempo, Robert Sinsheimer, de la Universidad de California, tuvo la idea de crear un instituto para secuenciar el genoma humano. Al mismo tiempo, el Departamento de Energía de Estados Unidos (DOE) también se interesó en el proyecto. Ellos habían estado estudiando cómo sus programas nucleares podían afectar la genética y causar cambios en el ADN.
Al principio, el Proyecto Genoma Humano tuvo algunos desafíos entre diferentes grupos de científicos. Había debates sobre la magnitud del proyecto, sus costos y las mejores formas de alcanzar los objetivos. A pesar de esto, el interés internacional creció, y en 1988, James Watson (uno de los descubridores de la estructura del ADN) asumió la dirección ejecutiva de la investigación del genoma humano en el NIH (Institutos Nacionales de la Salud). Se creó la organización HUGO (Organización del Genoma Humano) para coordinar el trabajo de investigación a nivel mundial y evitar que se repitieran esfuerzos.
Antes de los años ochenta, ya se conocían las secuencias de algunos genes de organismos pequeños como virus. En 1985, Robert Sinsheimer organizó un taller para discutir si era posible crear un mapa completo del genoma humano. En 1986, el Departamento de Energía de Estados Unidos (DOE) formalizó el Proyecto Genoma Humano.
En 1990, el Proyecto Genoma Humano se puso en marcha oficialmente. Se estimó que tomaría quince años. Sus primeros objetivos eran crear mapas genéticos y físicos muy detallados, mientras se desarrollaban nuevas técnicas para secuenciar todo el genoma. Se calculó que la parte estadounidense del proyecto costaría unos 3000 millones de dólares y terminaría en 2005.
La participación de empresas privadas
En 1998, surgió la primera empresa privada relacionada con el PGH, llamada Celera Genomics, fundada por Craig Venter. Esto hizo que la investigación se convirtiera en una especie de carrera para secuenciar y añadir rápidamente las secuencias a las bases de datos.
¿Qué resultados se obtuvieron?

El 6 de abril de 2000, se anunció públicamente el primer borrador del genoma humano secuenciado. En febrero de 2001, las revistas científicas Nature y Science publicaron la secuenciación definitiva del Genoma Humano, con un 99.9% de fiabilidad y un año antes de lo previsto. Finalmente, el genoma completo se anunció en abril de 2003. En mayo de 2006, se publicó la secuencia del último cromosoma humano en la revista Nature, marcando otro gran logro.
En junio de 2021, un grupo internacional de científicos anunció que habían secuenciado por primera vez el genoma humano completo. Esto incluyó un 8% del ADN que antes era difícil de leer por falta de tecnología. El "libro de instrucciones" de una persona tiene unos 3055 millones de "letras" o pares de bases.
Objetivos Principales del Proyecto Genoma Humano
Desde el inicio, el PGH tuvo dos objetivos principales, que estaban conectados y eran muy importantes:
- Secuenciación: Consistía en descubrir el orden exacto de todas las "letras" (nucleótidos) que forman el ADN del genoma.
- Cartografía o mapeo genético: Se trataba de localizar dónde se encuentra cada gen en los 23 pares de cromosomas humanos.
Identificación de los genes en el genoma humano
El genoma humano tiene aproximadamente 30 000 genes. Es interesante que esta cantidad es solo dos o tres veces mayor que la de la mosca de la fruta (Drosophila), y tenemos genes que son comunes incluso con bacterias.
Determinación de la secuencia de bases nitrogenadas que forman el ADN humano
Los humanos tenemos poco más de 3000 millones de bases nitrogenadas, un número similar al de otros animales con columna vertebral.
Almacenamiento de la información en bases de datos
Hoy en día, existen bases de datos donde se guarda toda la información del Proyecto Genoma Humano. Podemos acceder a ellas por internet para comparar los genomas de diferentes especies de animales y plantas. Esto nos ayuda a entender la función de los genes y cómo los cambios en ellos pueden afectar la creación de proteínas.
Transferencia de tecnología al sector privado
Una parte importante del proyecto fue permitir que la tecnología y los descubrimientos pasaran del ámbito público al privado. Esto ha generado debates, ya que por un lado amplía el acceso a los datos para más estudios, pero por otro, puede aumentar la influencia de ciertas empresas en la sociedad.
Supervisión de los temas éticos y sociales
El estudio de los aspectos éticos y sociales del PGH ha sido un tema muy debatido y ha requerido una gran inversión. Esto ha llevado a que otros proyectos de investigación, también importantes, recibieran menos apoyo o incluso fueran cancelados.
Donantes de genoma
Para el Proyecto Genoma Humano, se recolectaron muestras de muchos donantes diferentes, pero solo se estudiaron algunas de ellas. Esto se hizo para asegurar que la identidad de los donantes se mantuviera en secreto. Gran parte del ADN secuenciado provino de un único donante anónimo de Buffalo, Nueva York, conocido como "RP11". Los científicos usaron principalmente glóbulos blancos de dos hombres y dos mujeres elegidos al azar.
Beneficios del Proyecto Genoma Humano
El trabajo para entender los datos del genoma apenas comienza. Se espera que un conocimiento detallado del genoma humano abra nuevas puertas en la medicina y la biotecnología. Por ejemplo, algunas empresas ya ofrecen pruebas genéticas que pueden mostrar si una persona tiene más probabilidades de desarrollar ciertas enfermedades, como algunos tipos de cáncer o trastornos de la sangre.
Además, entender el genoma ayuda a los científicos a investigar enfermedades como el Alzheimer y otros problemas de salud. Esto podría llevar a grandes avances en cómo se manejan estas enfermedades.
Para los biólogos, hay muchos beneficios claros. Un investigador que estudia un tipo de cáncer, por ejemplo, puede haber identificado un gen específico. Al consultar la base de datos del genoma humano en internet, puede ver lo que otros científicos han descubierto sobre ese gen: su estructura, sus funciones, cómo se relaciona con genes de otros animales (como ratones o moscas), posibles cambios dañinos, cómo interactúa con otros genes, en qué tejidos del cuerpo está activo, y qué enfermedades se asocian con él.
El análisis de las similitudes entre las secuencias de ADN de diferentes organismos también está abriendo nuevas formas de estudiar la evolución. Muchas preguntas sobre las diferencias y similitudes entre los humanos y nuestros parientes más cercanos (como los primates) se espera que se aclaren con los datos de este proyecto.
El Proyecto Diversidad del Genoma Humano (PDGH), que estudia cómo el ADN humano varía entre diferentes grupos de personas, sigue adelante y ha revelado nuevas conclusiones. En el futuro, el PGH podría dar nueva información para el seguimiento de enfermedades, el desarrollo humano y la antropología. Podría descubrir secretos y crear nuevas estrategias para combatir la vulnerabilidad de ciertos grupos a enfermedades, y mostrar cómo las poblaciones humanas se han adaptado.
Además, el PGH tiene una consecuencia muy importante: permite conocer la base molecular de ciertas enfermedades hereditarias y diagnosticarlas.
Conocer las bases moleculares de las enfermedades hereditarias
Una de las aplicaciones más directas de conocer la secuencia de genes del genoma humano es que se puede entender la causa molecular de muchas enfermedades genéticas y hacer un diagnóstico adecuado. Algunas de estas enfermedades son:
- Enfermedad de Gaucher: Es causada por un cambio en un gen del cromosoma 1. Este gen da la instrucción para una enzima que ayuda a procesar ciertos lípidos. En las personas con Gaucher, estos lípidos se acumulan en órganos como el hígado y el bazo. Los síntomas incluyen dolores, fatiga y problemas óseos. Gracias al PGH, se pudo desarrollar la primera terapia efectiva para esta enfermedad, que ayuda a detener y revertir los síntomas.
- Enfermedad de Alzheimer: Es una enfermedad que afecta el cerebro, causando pérdida de memoria y juicio. El PGH ha ayudado a localizar marcadores genéticos para el Alzheimer de origen genético en los cromosomas 1, 14, 19 y 21.
- Enfermedad de Huntington: También es una enfermedad que afecta el cerebro, llevando a un deterioro mental. Suele aparecer entre los 30 y 50 años. Si uno de los padres la tiene, los hijos tienen un 50% de probabilidad de heredarla. En 1993, se logró aislar el gen que la causa, ubicado en el cromosoma 4. Las investigaciones buscan entender por qué se manifiesta tarde y encontrar una cura.
- Síndrome de Marfan: Es una enfermedad que afecta el tejido conectivo, que es como el "pegamento" del cuerpo. Afecta huesos, pulmones, ojos y corazón. Las personas con Marfan suelen tener extremidades largas y problemas cardíacos. Es una enfermedad hereditaria, y está asociada al gen FBN1 en el cromosoma 15, que es clave para formar fibras elásticas en los tejidos.
Diagnósticos de enfermedades posibles gracias al PGH
Gracias al conocimiento de las secuencias genéticas del genoma humano, se pueden diagnosticar enfermedades antes de que aparezcan los síntomas (diagnóstico presintomático) o incluso antes del nacimiento (diagnóstico prenatal).
El diagnóstico presintomático permite conocer si una persona desarrollará una enfermedad en el futuro, incluso si aún no tiene síntomas. Esto permite tomar medidas preventivas, como cambios en el estilo de vida o seguimientos médicos, para tratar la enfermedad antes de que se manifieste.
El diagnóstico prenatal es un conjunto de técnicas para saber si un bebé se está desarrollando correctamente antes de nacer. La técnica más común es la amniocentesis, que analiza el líquido que rodea al feto para detectar problemas en los cromosomas.
Terapia génica, terapia farmacológica y medicina predictiva
Una vez que se sabe qué genes causan enfermedades y cómo diagnosticarlas, el siguiente paso es desarrollar tratamientos. El PGH ha impulsado el desarrollo de la terapia génica, la terapia farmacológica y la medicina predictiva:
- La terapia génica busca curar enfermedades hereditarias insertando copias funcionales de genes que no funcionan bien o que faltan en el ADN de una persona. Esto podría corregir la causa de la enfermedad. Aunque es una técnica prometedora, aún se investiga cómo asegurar que el gen se inserte en el lugar correcto sin causar otros problemas. El primer caso conocido de terapia génica fue en una niña con una enfermedad de inmunodeficiencia severa, donde se modificaron sus glóbulos blancos para que produjeran una proteína que le faltaba.
- La terapia farmacológica se beneficia del PGH porque permite encontrar cambios en el ADN de genes específicos. Esto ayuda a crear medicamentos más personalizados que actúen directamente sobre la causa de la enfermedad, en lugar de solo aliviar los síntomas. También permite ajustar los medicamentos a las características genéticas de cada paciente, reduciendo los efectos secundarios.
- La medicina predictiva usa el conocimiento del genoma para diagnosticar enfermedades que aún no se han desarrollado en el paciente. Por ejemplo, puede identificar combinaciones de genes que aumentan el riesgo de enfermedades cardíacas. El objetivo es conocer exactamente qué combinaciones de genes son peligrosas para que las personas puedan tomar medidas preventivas. Sin embargo, la medicina predictiva también genera debates sobre la privacidad y la posibilidad de discriminación genética.
El Proyecto Genoma Humano y el Proteoma Humano
El Proyecto Genoma Humano nos da información sobre la estructura genética de una persona. Esta información es la base para entender muchas enfermedades y hacer diagnósticos. Pero, desde un punto de vista biológico, el PGH es el primer paso para un proyecto aún más grande y dinámico: el proyecto proteoma humano. Gracias a la proteómica, podemos entender cómo la información genética se convierte en proteínas que realizan funciones específicas en nuestro cuerpo.
Cifras y datos interesantes
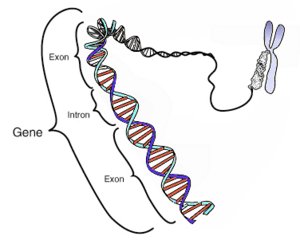
- El Consorcio Internacional (formado por 20 grupos de diferentes países) y la empresa privada Celera, publicaron el 12 de febrero de 2001, el mapa provisional del genoma humano.
- El Consorcio Internacional ha calculado que el genoma humano contiene unos 20 500 genes.
- El genoma humano tiene 3200 millones de pares de bases, distribuidos en 23 pares de cromosomas.
- Los humanos solo tenemos el doble de genes que la mosca de la fruta y un tercio más que el gusano común.
- Cada persona comparte el 99.99% del mismo código genético con el resto de los seres humanos. Solo 1250 "letras" (nucleótidos) separan a una persona de otra.
- Se han encontrado 223 genes humanos que son similares a los genes de las bacterias.
- Solo un 5% del genoma humano contiene instrucciones para crear proteínas. El 25% del genoma está casi vacío, con grandes espacios entre los genes.
- Se estima que existen entre 250 000 y 300 000 proteínas diferentes. Esto significa que cada gen podría estar involucrado en la creación de unas diez proteínas.
- Más del 35% del genoma contiene secuencias repetidas, a veces llamadas ADN no codificante.
- Se han identificado muchas pequeñas variaciones en los genes, llamadas polimorfismos de nucleótido único (SNP). La mayoría de estos cambios no tienen un efecto directo en la salud, pero pueden influir en cómo una persona reacciona a un medicamento o en su predisposición a ciertas enfermedades.
Finalización de la secuenciación del genoma
Telomere-to-Telomere (T2T)
En 2022, el Consorcio Telomere-to-Telomere (T2T) anunció que habían descubierto las secuencias finales de ADN del genoma humano, después de 32 años de estudio. El Proyecto Genoma Humano original terminó en 2003, habiendo descrito alrededor del 92% de la secuencia. Esta última parte se pudo completar gracias a herramientas computacionales más avanzadas. El genoma humano tiene unos 3 mil millones de bases en un orden muy preciso, y no se puede leer de una sola vez. Primero se determinan las secuencias de secciones pequeñas de ADN, y luego se usan para reconstruir la secuencia completa del genoma. La secuencia descrita por T2T incluye algunos genes y ADN repetitivo que se encuentra cerca de los telómeros (extremos de los cromosomas) y los centrómeros (partes centrales de los cromosomas).
Véase también
 En inglés: Human Genome Project Facts for Kids
En inglés: Human Genome Project Facts for Kids

