Ácido crómico para niños
Datos para niños
Ácido crómico |
||
|---|---|---|
a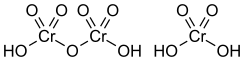  |
||
| Nombre IUPAC | ||
| Dihidroxidodioxidocromo (n. de adición) Dihidrogeno(tetraoxidocromato) (n. de hidrógeno) |
||
| General | ||
| Otros nombres | Ácido tetraoxocrómico (VI) (n. de Stock) Tetraoxocromato (VI) de hidrógeno Ácido crómico (VI) |
|
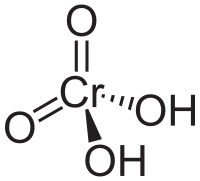
| Fórmula estructural | (OH)2O2Cr | |
| Fórmula molecular | H2CrO4 | |
| Identificadores | ||
| Número CAS | 7738-94-5 | |
| ChEBI | 33143 | |
| ChemSpider | 22834 | |
| PubChem | 24425 | |
| UNII | SA8VOV0V7Q | |
|
InChI
InChI=InChI=1S/Cr.2H2O.2O/h;2*1H2;;/q+2;;;;/p-2
Key: KRVSOGSZCMJSLX-UHFFFAOYSA-L |
||
| Propiedades físicas | ||
| Apariencia | Cristales rojos | |
| Densidad | 1201 kg/m³; 1,201 g/cm³ | |
| Masa molar | 117,935820456 g/mol | |
| Punto de fusión | 470 K (197 °C) | |
| Punto de ebullición | 523 K (250 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 1666,6 g/L | |
| Peligrosidad | ||
| NFPA 704 |
0
4
2
OX
|
|
| Frases R | R45 R46 R9 R24/25 R26 R35 R42/43 R48/23 | |
| Frases S | S43 S45 S60 S61 | |
| Riesgos | ||
| Riesgos principales |   |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El ácido crómico es un término que se usa de dos maneras principales. A veces, se refiere a una mezcla de ácido sulfúrico concentrado y dicromato de potasio o dicromato de amonio. Esta mezcla puede contener varios compuestos, como el trióxido de cromo sólido.
También, el ácido crómico puede ser un compuesto químico específico con la fórmula H2CrO4. Su "anhídrido" (una sustancia de la que se puede obtener el ácido al añadirle agua) es el trióxido de cromo, CrO3. En este ácido, el cromo tiene un estado de oxidación de +6. Es una sustancia muy fuerte que puede causar oxidación y es corrosivo.
Contenido
¿Qué es el Ácido Crómico Molecular?
El ácido crómico molecular, H2CrO4, es similar al ácido sulfúrico, H2SO4. Ambos son considerados ácidos fuertes. Esto significa que liberan fácilmente su primer protón (un átomo de hidrógeno con carga positiva) cuando están en una solución.
Cuando el ácido crómico molecular se deshidrata (pierde agua), se convierte en trióxido de cromo. Esto sucede si se añade ácido sulfúrico concentrado a una solución de dicromato. La solución cambia de naranja a rojo, y luego aparecen cristales rojos oscuros de trióxido de cromo.
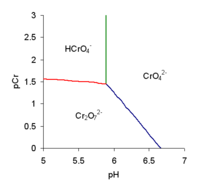
¿Qué es el Ácido Dicrómico?
El ácido dicrómico, H2Cr2O7, es otra forma relacionada con el ácido crómico. Se puede ver como el resultado de añadir trióxido de cromo al ácido crómico molecular.
Es probable que el ácido dicrómico esté presente en las mezclas de ácido crómico que se usan para limpiar el vidrio.
Usos del Ácido Crómico
El ácido crómico es importante en varios procesos industriales y de laboratorio.
Usos Industriales y de Limpieza
- Es un paso intermedio en el proceso de cromado, que es cuando se recubre un objeto con una capa de cromo.
- Se usa en los esmaltes de cerámica para darles color.
- También se utiliza para colorear el vidrio.
- Las mezclas de ácido crómico con ácido sulfúrico, conocidas como mezcla sulfocrómica o ácido cromosulfúrico, son muy buenas para limpiar el material de vidrio de laboratorio. Son especialmente útiles para quitar residuos orgánicos difíciles de eliminar. Sin embargo, su uso ha disminuido por preocupaciones sobre el medio ambiente.
Uso en Instrumentos Musicales
- En el pasado, el ácido crómico se usaba mucho en la reparación de instrumentos musicales de metal. Ayudaba a "iluminar" el latón sin tratar, dejando una capa de color amarillo brillante en el bronce.
- Actualmente, su uso en estos talleres ha disminuido debido a las preocupaciones sobre la salud y el medio ambiente.
Reacciones Químicas del Ácido Crómico
El ácido crómico es un agente oxidante muy potente. Esto significa que puede quitar electrones a otras sustancias, lo que provoca cambios químicos. Por esta razón, se han creado diferentes versiones de este reactivo para oxidar compuestos orgánicos.
Reactivos Especiales
- El reactivo de Jones es una mezcla de ácido crómico en ácido sulfúrico acuoso y acetona. Se usa para transformar ciertos tipos de alcoholes en ácidos carboxílicos o cetonas.
- El clorocromato de piridinio se forma a partir de trióxido de cromo. Este reactivo convierte los alcoholes primarios en aldehídos.
- El reactivo de Collins es otro compuesto que contiene trióxido de cromo y se usa para diferentes reacciones de oxidación.
Ejemplos de Transformaciones
- Puede transformar metilbencenos en ácido benzoico.
- Puede oxidar un alcohol secundario para convertirlo en una cetona.
Uso en Análisis Químico
En química orgánica, las soluciones diluidas de cromo hexavalente (como el ácido crómico) se pueden usar para identificar la presencia de ciertos alcoholes. Cuando el ácido crómico oxida alcoholes primarios o secundarios, cambia de color naranja a azul-verdoso. Este cambio de color sirve como una prueba para saber si hay alcoholes primarios o secundarios en una muestra. Los alcoholes terciarios no reaccionan de esta manera.
Alternativas al Ácido Crómico
Para oxidar alcoholes o aldehídos y obtener ácidos carboxílicos, existen otros reactivos además del ácido crómico. Por ejemplo, las sales de níquel (II) pueden catalizar la oxidación con hipoclorito de sodio. Cada oxidante tiene sus propias ventajas y desventajas.
Seguridad con el Ácido Crómico
Los compuestos que contienen cromo hexavalente, como el ácido crómico, son muy peligrosos. Pueden ser dañinos para la salud y se ha demostrado que pueden causar enfermedades graves. Por esta razón, las oxidaciones que usan ácido crómico no se emplean a gran escala en la industria. Es fundamental manejar estas sustancias con mucho cuidado y siguiendo estrictas normas de seguridad.
Véase también
 En inglés: Chromic acid Facts for Kids
En inglés: Chromic acid Facts for Kids