Pentano para niños
Datos para niños
Pentano |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Pentano | ||
| General | ||
| Otros nombres | n-pentano Pentano normal |
|
| Fórmula semidesarrollada | CH3CH2CH2CH2CH3 | |
| Fórmula molecular | C5H12 | |
| Identificadores | ||
| Número CAS | 109-66-0 | |
| Número RTECS | RZ9450000 | |
| ChEBI | 37830 | |
| ChEMBL | CHEMBL16102 | |
| ChemSpider | 7712 | |
| PubChem | 8003 | |
| UNII | 4FEX897A91 | |
|
InChI
InChI=InChI=1S/C5H12/c1-3-5-4-2/h3-5H2,1-2H3
Key: OFBQJSOFQDEBGM-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 630 kg/m³; 0,63 g/cm³ | |
| Masa molar | 72,15 g/mol | |
| Punto de fusión | 143,3 K (−130 °C) | |
| Punto de ebullición | 309,1 K (36 °C) | |
| Temperatura crítica | 469,8 K (197 °C) | |
| Presión crítica | 33.6 ± 0.6 atm | |
| Viscosidad | 0.240 cP at 20 °C | |
| Índice de refracción (nD) | 1.35768 (20 °C) | |
| Propiedades químicas | ||
| Acidez | -45 pKa | |
| Solubilidad en agua | 0.36 g/L a 20 °C | |
| Momento dipolar | 0.007 D D | |
| Termoquímica | ||
| ΔfH0gas | -146.8 ± 0.59 kJ/mol | |
| ΔfH0líquido | -173.5 ± 0.59 kJ/mol | |
| S0gas, 1 bar | 347.82 ± 0.84 J·mol–1·K | |
| S0líquido, 1 bar | 263.47 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 233 K (−40 °C) | |
| NFPA 704 |
4
1
0
?
|
|
| Temperatura de autoignición | 533 K (260 °C) | |
| Frases R | R12, R20/22, R36/37/38 | |
| Frases S | S2, S7, S9, S16, S23.2, S28.1, S29, S33, S36, S61, S62 | |
| Límites de explosividad | 1,4 a 8,3% vol. | |
| Riesgos | ||
| Ingestión | Puede causar irritación del tracto digestivo. Los síntomas pueden incluir: dolor de cabeza, agitación, fatiga, náuseas, vómitos, estupor y coma. Puede causar irritación gastrointestinal con náuseas, vómitos y diarrea. Puede causar depresión del sistema nervioso central, caracterizada por excitación, seguido de dolor de cabeza, mareos, somnolencia y náuseas. En etapas avanzadas puede causar colapso, inconsciencia, coma y posible muerte por insuficiencia respiratoria. La aspiración del material en los pulmones puede causar neumonitis química, que puede ser mortal. La ingestión de grandes cantidades puede causar depresión del SNC. | |
| Inhalación | La inhalación de altas concentraciones puede causar efectos en el sistema nervioso central, caracterizado por dolor de cabeza, mareos, pérdida del conocimiento y coma. Puede causar irritación de las vías respiratorias. La aspiración puede provocar edema pulmonar. Los vapores pueden causar mareos o sofocación. Puede causar una sensación de ardor en el pecho. | |
| Piel | Causa irritación de la piel. Puede causar irritación y dermatitis. Puede causar cianosis de las extremidades. | |
| Ojos | Causa irritación de los ojos. Puede causar conjuntivitis química y daño de la córnea. | |
| Compuestos relacionados | ||
| Alcanos | Butano, Hexano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El pentano es un tipo de hidrocarburo llamado alcano. Su fórmula química es C5H12. Esto significa que cada molécula de pentano tiene 5 átomos de carbono y 12 átomos de hidrógeno.
A diferencia de otros alcanos más pequeños, como el metano o el butano, el pentano es un líquido a temperatura ambiente.
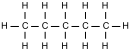
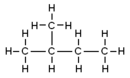
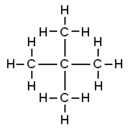
La palabra 'pentano' puede referirse a varias formas de esta molécula, llamadas isómeros. Los isómeros son compuestos con la misma fórmula química, pero con los átomos organizados de manera diferente. Según las reglas de la IUPAC, 'pentano' se usa específicamente para el n-pentano, que tiene una cadena recta de átomos de carbono. Los otros dos isómeros se llaman metilbutano y dimetilpropano.
| Nombre común | pentano normal n-pentano pentano lineal n-pentano |
isopentano i-pentano |
neopentano |
| Nombre IUPAC |
pentano | metilbutano | dimetilpropano |
| Diagrama molecular |
 |
 |
 |
| Diagrama del esqueleto |
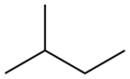 |
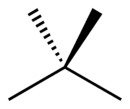 |
Los pentanos son parte de algunos combustibles. También se usan en laboratorios como disolventes. Sus características son muy parecidas a las de los butanos y hexanos.
Contenido
¿Para qué se usa el pentano en la industria?
El n-pentano es un componente importante en la fabricación de espuma de poliestireno. Se utiliza como un "agente espumante", que ayuda a crear la estructura ligera y porosa de la espuma.
Además, el pentano se usa en algunas centrales de energía geotérmica. Es un buen "medio de trabajo" porque tiene un punto de ebullición bajo, es económico y relativamente seguro.
¿Cómo se utiliza el pentano en el laboratorio?
Los pentanos son económicos y son los alcanos líquidos más fáciles de evaporar. Por eso, son muy útiles en los laboratorios como disolventes.
Sin embargo, debido a su falta de polaridad, solo pueden disolver sustancias que no son polares. Esto incluye compuestos con muchos grupos alquilo.
Los pentanos se mezclan bien con la mayoría de los disolventes no polares. Algunos ejemplos son los clorocarbonos y los éteres. También se usan a menudo en la cromatografía, una técnica para separar mezclas.
¿Cuáles son las propiedades físicas del pentano?
Las propiedades físicas del pentano y sus isómeros son importantes para entender cómo se comportan.
| Isómero | Temperatura de Fusión (°C) | Temperatura de Ebullición (°C) | Densidad (g/l) |
| n-pentano | -129.8 | 36.1 | 621 |
| isopentano | -159.9 | 27.9 | 616 |
| neopentano | -16.6 | 9.5 | 586 |
Puntos de ebullición
Los puntos de ebullición de los isómeros del pentano varían entre 9 y 36 °C. Los isómeros que tienen más "ramas" en su estructura suelen tener puntos de ebullición más bajos. Esto se debe a que las moléculas ramificadas no pueden empaquetarse tan cerca unas de otras.
Puntos de fusión
El punto de fusión del isopentano es solo 30 °C más bajo que el del n-pentano. Sin embargo, el neopentano tiene un punto de fusión más de 100 °C más alto que el isopentano. Esta diferencia se debe a cómo se organizan las moléculas en estado sólido. La molécula de neopentano, que tiene forma de tetraedro, puede empaquetarse de manera más eficiente.
Por la misma razón, el neopentano es menos denso que los otros dos isómeros.
Estabilidad de los isómeros
Los isómeros ramificados son más estables que el pentano normal. Esto significa que liberan menos energía cuando se forman o cuando se queman. La diferencia es de 1.8 kcal/mol para el isopentano y 5 kcal/mol para el neopentano.
Rotación molecular
En el n-pentano, los enlaces simples entre los átomos de carbono (C-C) pueden girar. Esta rotación permite que la molécula adopte cuatro formas diferentes, llamadas isómeros conformacionales.
¿Qué reacciones químicas puede tener el pentano?
El pentano puede participar en varias reacciones químicas.
Combustión
Todos los isómeros del pentano pueden arder en presencia de oxígeno. Cuando esto ocurre, forman dióxido de carbono y vapor de agua.
- C5H12 + 8 O2 → 5 CO2 + 6 H2O
Reacciones con halógenos
Los pentanos también pueden reaccionar con halógenos, como el cloro. Esta reacción se llama halogenación y ocurre a través de un mecanismo de radicales libres.
- C5H12 + Cl2 → C5H11Cl + HCl
Estas reacciones no son muy específicas. Por ejemplo, al reaccionar n-pentano con cloro, se obtiene una mezcla de diferentes productos. Entre ellos están el 1-cloropentano, el 2-cloropentano y el 3-cloropentano, además de otros compuestos con más átomos de cloro.
Producción de anhídrido maleico
Aunque el butano es la materia prima más común, el n-pentano también se usa para fabricar anhídrido maleico. Este es un compuesto químico importante en la industria.
- CH3CH2CH2CH2CH3 + 5 O2 → C2H2(CO)2O + 5 H2O + CO2
Galería de imágenes
Ver también
Véase también
 En inglés: Pentane Facts for Kids
En inglés: Pentane Facts for Kids



