Proteína para niños
Las proteínas son macromoléculas muy importantes para la vida. Están formadas por cadenas largas de unidades más pequeñas llamadas aminoácidos. La forma en que se unen estos aminoácidos está definida por la información que se encuentra en nuestros genes. Esta información genética es como un manual de instrucciones que le dice a cada célula, tejido y organismo qué proteínas debe tener y cómo deben funcionar.
Las proteínas se fabrican en unas estructuras diminutas de la célula llamadas ribosomas. Este proceso se guía por una molécula llamada ARNm, que lleva el mensaje de los genes.
Algunas proteínas están hechas de una sola cadena de aminoácidos y se llaman proteínas monoméricas. Otras, llamadas oligoméricas, tienen varias cadenas unidas. Un ejemplo de proteína monomérica es la mioglobina, y de oligomérica, la hemoglobina. Para funcionar correctamente, muchas proteínas necesitan unirse a otras moléculas orgánicas o a iones, como ocurre con la mayoría de las enzimas.
Las proteínas son muy diversas y cumplen funciones esenciales para la vida. Son como los "ladrillos" de nuestras células, formando el 80% de su estructura seca. También actúan como biorreguladores (parte de las enzimas) y nos defienden (los anticuerpos son proteínas). Por eso, el crecimiento, la reparación y el mantenimiento de nuestro cuerpo dependen de ellas. Constituyen aproximadamente el 50% del peso seco de nuestros tejidos.
La ubicación y el momento en que se producen las proteínas en el cuerpo dependen de cómo se activan o desactivan los genes. El conjunto completo de proteínas que un organismo produce en un momento dado se llama proteoma.
Contenido
- ¿Qué son las proteínas a nivel químico?
- ¿Cómo se fabrican las proteínas?
- ¿Qué funciones tienen las proteínas?
- ¿Cómo se organizan las proteínas?
- Propiedades importantes de las proteínas
- ¿Qué pasa si una proteína pierde su forma?
- ¿Cómo se estudia la estabilidad de las proteínas?
- Clasificación de las proteínas
- Proteínas en nuestra alimentación
- ¿Cómo se digieren las proteínas?
- ¿Cómo se estudian las proteínas?
- Historia del estudio de las proteínas
- Galería de imágenes
- Véase también
¿Qué son las proteínas a nivel químico?
Las proteínas son biopolímeros, es decir, moléculas grandes formadas por muchas unidades más pequeñas llamadas aminoácidos. Estos aminoácidos se unen entre sí mediante enlaces especiales llamados enlaces peptídicos. Cada vez que se forma uno de estos enlaces, se libera una molécula de agua.
Los aminoácidos que forman nuestras proteínas son de un tipo específico llamado L-α-aminoácidos. La mayoría de los seres vivos usan combinaciones de 20 aminoácidos diferentes, que están definidos por el código genético. También existen aminoácidos modificados que se encuentran en algunas proteínas.
Debido a su gran tamaño, las proteínas forman dispersiones coloidales en el agua, lo que les da propiedades especiales. Muchas proteínas tienen carga eléctrica, lo que significa que pueden comportarse como iones.
Todas las proteínas contienen carbono, hidrógeno, oxígeno y nitrógeno, y casi todas también tienen azufre. El nitrógeno es un elemento clave en las proteínas, representando alrededor del 16% de su peso total.
La fabricación de proteínas es un proceso complejo que ocurre dentro de las células, siguiendo las instrucciones de los genes. La secuencia de aminoácidos de una proteína está codificada en su gen, que es una parte del ADN. A veces, los aminoácidos de una proteína sufren cambios químicos después de ser creados, lo que se conoce como modificación postraduccional. Las proteínas también pueden unirse entre sí para formar complejos proteicos estables y cumplir funciones específicas.
Las proteínas se pueden clasificar según su composición química en:
- Proteínas simples: Formadas solo por aminoácidos. Por ejemplo, la insulina.
- Proteínas conjugadas: Formadas por aminoácidos y otras sustancias no proteicas, llamadas grupos prostéticos. Por ejemplo, la mioglobina.
¿Cómo se fabrican las proteínas?
Biosíntesis de proteínas
Las proteínas se construyen a partir de sus aminoácidos siguiendo las instrucciones que están guardadas en los genes. Cada proteína tiene una secuencia única de aminoácidos, que está especificada por la secuencia de nucleótidos de su gen. El código genético usa "palabras" de tres nucleótidos, llamadas codones, para indicar qué aminoácido debe ir en cada lugar. Por ejemplo, el codón AUG significa metionina. Como hay 64 codones posibles, algunos aminoácidos pueden ser codificados por más de un codón.
En las células eucariotas, los genes del ADN se copian primero en una molécula llamada ARN pre-mensajero. Luego, este ARN se modifica para formar un ARNm maduro, que viaja desde el núcleo celular hasta el citoplasma. Allí, en los ribosomas, el ARNm se usa como molde para construir la proteína. En las células procariotas, el ARNm se puede usar para fabricar proteínas casi al mismo tiempo que se produce.
El proceso de fabricar una proteína a partir de un molde de ARNm se llama traducción. El ribosoma lee el ARNm de tres nucleótidos en tres nucleótidos (codones). Cada codón se empareja con una molécula de ARN de transferencia (ARNt) que lleva el aminoácido correcto. Las proteínas se construyen siempre desde el extremo N-terminal hasta el extremo C-terminal.
Una vez que la cadena de aminoácidos está completa, debe plegarse de una forma específica para poder funcionar. Se cree que toda la información necesaria para este plegamiento está en la secuencia de aminoácidos. Aunque el plegamiento parece complejo, las proteínas lo hacen de forma rápida y espontánea, siguiendo un camino específico. Algunas proteínas, llamadas chaperonas moleculares, incluso ayudan a otras a plegarse correctamente.
El tamaño de una proteína se mide por el número de aminoácidos que contiene y por su masa molecular, que se expresa en daltons (Da) o kilodaltons (kDa). Por ejemplo, las proteínas de la levadura tienen en promedio 466 aminoácidos. Las proteínas más grandes conocidas son las titinas, que tienen casi 27,000 aminoácidos.
Degradación de proteínas
Así como las proteínas se fabrican, también se degradan o "descomponen" en un proceso controlado. Las proteínas que van a ser degradadas son marcadas con una pequeña molécula llamada ubiquitina. Este proceso es muy importante y se ha conservado a lo largo de la evolución en muchos seres vivos.
¿Qué funciones tienen las proteínas?
Las proteínas realizan funciones vitales para las células y el organismo. Muchas proteínas pueden tener más de una actividad. Aquí te presentamos algunas de sus funciones principales:
- Enzimática: Las enzimas son proteínas que aceleran las reacciones químicas en el cuerpo, haciéndolas más rápidas y eficientes. Por ejemplo, la pepsina en el sistema digestivo ayuda a descomponer los alimentos.
- Reguladoras: Algunas proteínas, como las hormonas, ayudan a mantener el equilibrio en el cuerpo (homeostasis). Un ejemplo es la insulina, que regula el nivel de glucosa en la sangre.
- Estructural: Muchas proteínas dan forma y soporte a las células y tejidos. Forman estructuras como cables o rieles que dirigen el movimiento. La tubulina es parte del citoesqueleto de las células. La colágena da resistencia y elasticidad a los tejidos conectivos.
- Defensiva: Protegen al organismo contra elementos extraños. Las inmunoglobulinas (anticuerpos) nos defienden de infecciones. La queratina protege nuestra piel, y el fibrinógeno y la protrombina ayudan a formar coágulos para detener hemorragias.
- Transporte: Estas proteínas llevan sustancias a donde se necesitan en el cuerpo. La hemoglobina, por ejemplo, transporta el oxígeno en la sangre. Otras proteínas permiten el paso de sustancias a través de las membranas celulares.
- Receptoras: Se encuentran en la membrana celular y reciben señales para que la célula pueda realizar sus funciones. El receptor de acetilcolina recibe señales para la contracción muscular.
- Motoras: Actúan como pequeños motores que mueven componentes dentro de las células. La actina y la miosina son ejemplos de proteínas que permiten la contracción muscular.
- Reserva y almacenamiento: Sirven como fuente de energía y materiales. La ovoalbúmina en el huevo y la caseína en la leche son ejemplos. La ferritina almacena hierro.
Además, muchas proteínas en el citoplasma ayudan a mantener el pH adecuado en las células, actuando como un tampón químico.
¿Cómo se organizan las proteínas?
La forma en que una proteína se organiza es crucial para su función. Si las condiciones del ambiente (como la temperatura o el pH) cambian, la proteína puede perder su forma y, por lo tanto, su función. Este proceso se llama desnaturalización. La función de una proteína depende de su forma, y esta forma está determinada por la secuencia de aminoácidos.
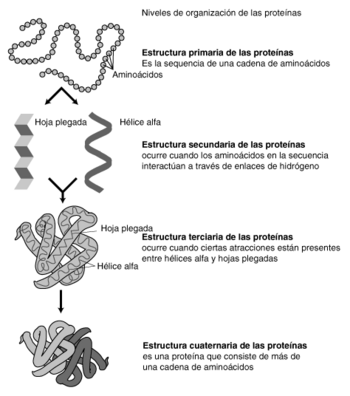
Para entender la estructura de una proteína, se suelen describir cuatro niveles de organización:
Niveles estructurales de las proteínas
- Estructura primaria: Es simplemente la secuencia lineal de aminoácidos en la cadena.
- Estructura secundaria: Son patrones de plegamiento que aparecen en ciertas partes de la proteína, como las hélices o las láminas.
- Estructura terciaria: Es la forma tridimensional completa que adopta una sola cadena de proteína.
- Estructura cuaternaria: Se refiere a cómo se organizan varias cadenas de proteínas (subunidades) para formar un complejo funcional.
Las proteínas adquieren su estructura de forma muy rápida, no pasando por cada nivel uno por uno.
Dentro de la forma tridimensional de una proteína, podemos encontrar:
Giros
Son curvas cortas en la superficie de la proteína, que cambian la dirección de la cadena de aminoácidos.
Bucles
Son curvas más largas y flexibles que los giros.
Motivos
Son combinaciones específicas de estructuras secundarias que se repiten en diferentes proteínas y a menudo están relacionadas con una función particular. Algunos ejemplos son la hélice-giro-hélice o el dedo de cinc.
Dominios
Son partes de la estructura terciaria de las proteínas que se pliegan de forma independiente y son estables por sí mismas. Pueden estar formados por diferentes combinaciones de motivos.
Propiedades importantes de las proteínas
Las proteínas tienen cinco propiedades principales que les permiten existir y funcionar:
- Amortiguador de pH: Pueden mantener el pH estable en el cuerpo, actuando como ácidos o bases.
- Capacidad electrolítica: Pueden moverse en un campo eléctrico debido a su carga.
- Especificidad: Cada proteína tiene una función muy específica, determinada por su secuencia de aminoácidos.
- Estabilidad: Deben ser estables en el ambiente donde trabajan. Muchas proteínas acuosas tienen un centro "escondido" de partes que no les gusta el agua.
- Solubilidad: Se mantienen disueltas en el agua siempre que sus enlaces estén intactos. Si la temperatura o el pH cambian mucho, pueden perder su solubilidad.
Estas propiedades se deben a que las proteínas pueden:
- Unirse a otras biomoléculas, incluyendo otras proteínas.
- Acelerar reacciones químicas.
- Plegarse para formar canales o poros.
¿Qué pasa si una proteína pierde su forma?
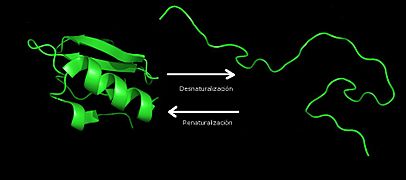
Para que una proteína funcione, debe mantener su forma correcta. Si esta forma se altera, la proteína pierde sus propiedades y funciones. A este proceso se le llama desnaturalización.
Cuando las proteínas se desnaturalizan, por ejemplo, por cambios bruscos de temperatura o pH, pierden su forma original. Las enzimas, por ejemplo, pierden su capacidad de acelerar reacciones. La desnaturalización no rompe los enlaces principales de la proteína, por lo que a veces, si las condiciones vuelven a la normalidad, la proteína puede recuperar su forma original, lo que se llama renaturalización.
Los factores que causan la desnaturalización se llaman agentes desnaturalizantes. Estos pueden ser cambios de temperatura, pH, sales, o la adición de ciertos líquidos.
En las proteínas globulares, la forma "nativa" (funcional) es compacta, con las partes que no les gusta el agua escondidas dentro y las partes que sí les gusta el agua expuestas. Cuando se desnaturalizan, estas partes "escondidas" quedan expuestas. A menudo, las proteínas desnaturalizadas se agrupan y se precipitan.
Algunos agentes desnaturalizantes pueden incluso romper enlaces fuertes, haciendo imposible que la proteína recupere su forma original.
Ejemplos comunes de desnaturalización son cuando la leche se "corta" (la caseína se desnaturaliza), o cuando la clara de huevo se vuelve blanca y sólida al cocinarse (la ovoalbúmina se desnaturaliza por el calor).
¿Cómo se estudia la estabilidad de las proteínas?
La estabilidad de una proteína se puede medir con varias técnicas. Una de ellas es la calorimetría, que mide cuánto calor absorbe una proteína al calentarse, lo que indica cuándo cambia de su estado funcional a uno desnaturalizado.
Otras técnicas miden propiedades que cambian cuando la proteína se desnaturaliza, como la fluorescencia, el dicroísmo circular o la resonancia magnética nuclear. Estas técnicas pueden usar el aumento de temperatura o agentes químicos para provocar la desnaturalización.
Estudiar la estabilidad de las proteínas es muy importante para entender enfermedades como el Alzheimer o el Parkinson, donde las proteínas desnaturalizadas forman acumulaciones dañinas. También es clave en la biotecnología, ya que muchas proteínas usadas como medicamentos necesitan ser estables para funcionar correctamente.
Clasificación de las proteínas
Las proteínas se pueden clasificar de varias maneras:
Según su forma
- Fibrosas: Tienen cadenas largas y una estructura repetitiva. Suelen ser insolubles en agua y tienen funciones estructurales, como la queratina (en el pelo) y el colágeno (en la piel y tejidos).
- Globulares: Sus cadenas se doblan en una forma esférica y compacta, con las partes que les gusta el agua hacia afuera, lo que las hace solubles en agua. La mayoría de las enzimas, anticuerpos y hormonas son globulares.
- Mixtas: Tienen una parte fibrosa y otra globular.
Según su solubilidad
- Proteínas globulares (ver arriba).
- Proteínas fibrosas (ver arriba).
- Proteínas integrales de membrana: Se encuentran en las membranas de las células y tienen partes que se adaptan a la zona que no le gusta el agua de la membrana.
- Proteínas intrínsecamente desordenadas: Tienen una estructura flexible que cambia según con qué interactúen. Son comunes en células eucariotas.
Según su composición química
- Proteínas simples o holoproteínas: Solo contienen aminoácidos. Ejemplos: insulina, colágeno.
- Proteínas conjugadas o heteroproteínas: Contienen aminoácidos y un grupo no proteico (grupo prostético). Este grupo puede ser un ácido nucleico, un lípido, un azúcar o un metal. Ejemplos: mioglobina, citocromo.
Proteínas en nuestra alimentación
Fuentes de proteínas
Podemos obtener proteínas de muchos alimentos. Las fuentes animales incluyen carne, huevos y productos lácteos como el queso y el yogur. Las fuentes vegetales incluyen legumbres, frutos secos, cereales y verduras. Tanto las proteínas animales como las vegetales contienen los 20 aminoácidos que nuestro cuerpo necesita.
Calidad de las proteínas
No todas las proteínas son iguales para nuestro cuerpo. Se han creado diferentes métodos para medir qué tan bien nuestro cuerpo usa y retiene las proteínas. Estos métodos nos ayudan a saber cuáles son las proteínas más eficientes para nuestra nutrición.
Requerimientos de proteínas por edad y sexo
La cantidad de proteínas que necesitamos al día varía según nuestra edad y sexo. Aquí tienes una tabla con las cantidades recomendadas:
| Edad
(años) |
Peso
(kg) |
Proteínas
(g/día) |
|
|---|---|---|---|
| Lactantes | 0-0.5
0.5 |
6
9 |
13
14 |
| Niños | 1-3
4-6 7-10 |
13
20 28 |
16
24 28 |
| Hombres | 11-14
15-18 19-24 25-50 más de 50 |
45
66 72 79 77 |
45
59 58 63 63 |
| Mujeres | 11-14
15-18 19-24 25- 50 más de 50 |
46
55 58 63 65 |
46
44 46 50 50 |
- Food and Nutrition Board, National Academy of Science/National Research Council 1989
Falta de proteínas
La falta de proteínas es una causa importante de problemas de salud en algunos países. Puede llevar a enfermedades como el kwashiorkor. Factores como la guerra o la hambruna pueden aumentar la malnutrición y la falta de proteínas. Una deficiencia grave puede afectar la capacidad del cuerpo para combatir infecciones.
En países desarrollados, la falta de proteínas es menos común, pero puede ocurrir en personas con dietas muy restrictivas, adultos mayores con mala alimentación, o quienes se recuperan de cirugías o enfermedades y no aumentan su consumo.
Consumo excesivo de proteínas
Nuestro cuerpo no puede almacenar el exceso de proteínas. Si consumimos demasiadas, el cuerpo las convierte en azúcares o ácidos grasos. El hígado procesa el nitrógeno de los aminoácidos, y este nitrógeno se elimina a través de los riñones en forma de urea. Si los riñones no funcionan bien, un consumo muy alto de proteínas podría ser un problema.
Algunos estudios sugieren que el consumo excesivo de proteínas podría estar relacionado con:
- Problemas en el hígado debido al aumento de residuos.
- Una respuesta exagerada del sistema inmune.
- Pérdida de densidad ósea, ya que el cuerpo podría usar calcio de los huesos para equilibrar el aumento de ácidos en la dieta. Sin embargo, si se consumen suficientes minerales de frutas y verduras, este efecto puede no presentarse.
Las proteínas también pueden causar alergias alimentarias. Esto sucede porque la estructura de cada proteína es ligeramente diferente, y algunas pueden activar una respuesta del sistema inmune. Muchas personas son alérgicas a la caseína (en la leche), al gluten (en el trigo) o a las proteínas del maní o los mariscos.
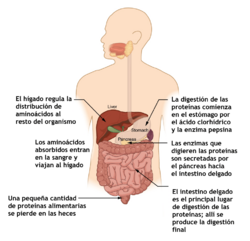
¿Cómo se digieren las proteínas?
La digestión de las proteínas comienza en el estómago con la acción de la pepsina, y continúa en el intestino con otras enzimas como la tripsina y la quimotripsina. Las proteínas de los alimentos se descomponen en péptidos cada vez más pequeños, y finalmente en aminoácidos, que son absorbidos por el epitelio gastrointestinal. La velocidad de absorción de los aminoácidos depende de la fuente de proteínas.
Los aminoácidos no solo se usan para construir proteínas, sino que también son una fuente importante de nitrógeno y energía. Las proteínas, al igual que los carbohidratos, aportan cuatro kilocalorías por gramo. Los aminoácidos pueden convertirse en glucosa a través de un proceso llamado gluconeogénesis.
¿Cómo se estudian las proteínas?
Las proteínas se pueden estudiar de varias maneras:
- In vitro: Se estudian proteínas purificadas en un ambiente controlado en el laboratorio para entender cómo funcionan.
- In vivo: Se estudian las proteínas dentro de una célula o un organismo completo para ver su papel en un contexto real.
- In silico: Se usan métodos computacionales para estudiar las proteínas.
Purificación de proteínas
Para estudiar una proteína en el laboratorio, primero hay que separarla de otros componentes de la célula. Esto suele empezar rompiendo la célula para liberar su contenido. Luego, se usan técnicas como la centrifugación o la cromatografía para aislar la proteína deseada, basándose en propiedades como su tamaño, carga o capacidad de unirse a otras moléculas.
A veces, se usa la ingeniería genética para añadir "etiquetas" químicas a las proteínas, lo que facilita su purificación sin cambiar su función. Por ejemplo, se puede añadir una secuencia de aminoácidos que se une al níquel, permitiendo que la proteína se adhiera a una columna de cromatografía mientras otras sustancias pasan de largo.
Localización celular
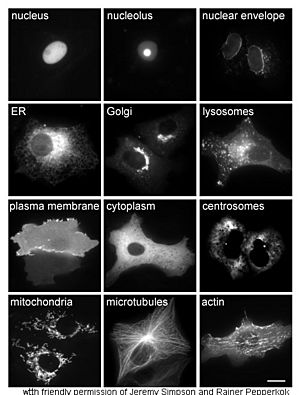
Para saber dónde se encuentra una proteína dentro de la célula, se puede usar la ingeniería genética para unir la proteína de interés a una proteína verde fluorescente. Así, se puede ver su ubicación claramente con un microscopio.
También se pueden usar marcadores fluorescentes o anticuerpos para identificar compartimentos celulares conocidos, lo que ayuda a localizar la proteína de interés.
Historia del estudio de las proteínas
- 1838: El químico Jöns Jacob Berzelius propuso el nombre "Proteína" (del griego proteios, que significa "primero" o "principal") para una sustancia compleja rica en nitrógeno encontrada en células animales y vegetales.
- 1819-1904: Se descubrieron la mayoría de los 20 aminoácidos comunes en las proteínas.
- 1864: Felix Hoppe-Seyler cristalizó y nombró por primera vez la hemoglobina.
- 1894: Hermann Emil Fischer propuso la analogía de "llave y cerradura" para explicar cómo las enzimas interactúan con otras moléculas.
- 1897: Buchner y Buchner demostraron que los extractos de levadura sin células podían fermentar el azúcar, sentando las bases de la enzimología.
- 1926: James Batcheller Sumner cristalizó la ureasa y demostró que las proteínas pueden tener actividad catalítica (actuar como enzimas).
- 1933: Arne Wilhelm Kaurin Tiselius introdujo la electroforesis para separar proteínas en solución.
- 1951: Linus Carl Pauling y Robert Corey propusieron las estructuras de la "hélice α" y la "lámina β", que se encontraron en muchas proteínas.
- 1955: Frederick Sanger determinó por primera vez la secuencia de aminoácidos de una proteína (la insulina).
- 1960: John Kendrew describió la primera estructura tridimensional detallada de una proteína (la mioglobina).
- 1969: Cyrus Levinthal propuso la paradoja de Levinthal sobre el plegamiento de las proteínas.
- 1972: Christian B. Anfinsen recibió el Premio Nobel de Química por sus trabajos sobre el plegamiento de las proteínas.
- 1995: Marc R. Wilkins acuñó el término "Proteoma" para referirse a todas las proteínas presentes en una célula.
Galería de imágenes
Véase también
 En inglés: Protein Facts for Kids
En inglés: Protein Facts for Kids
- Acuaporina
- Aminoácido
- Biosíntesis proteica
- Biuret
- Catepsina
- Citocina
- Código genético
- Cucumisina
- Holoproteína
- Proteína completa
- Proteína conjugada
- Proteína G
- Proteasoma
- Proteómica
- Receptor intracelular
- Timina
- Traducción (genética)
- Valor biológico