Anticuerpo para niños
Los anticuerpos, también conocidos como inmunoglobulinas (Ig), son proteínas especiales que se encuentran en la sangre y otros líquidos del cuerpo de los animales vertebrados. Son como los "detectives" de nuestro sistema inmunitario, encargados de identificar y neutralizar elementos extraños que pueden hacernos daño, como bacterias y virus.
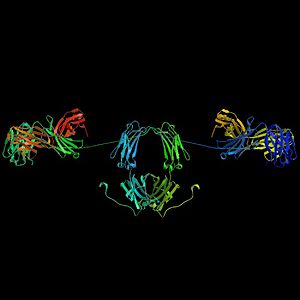
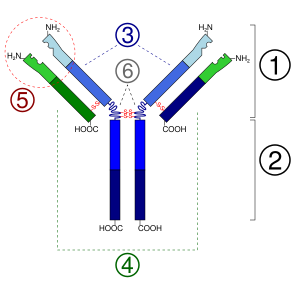
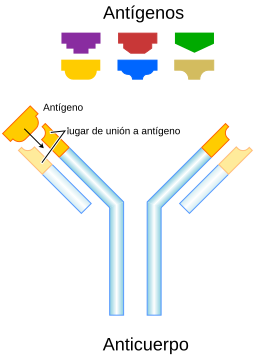
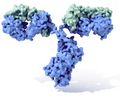
Un anticuerpo típico tiene una forma de "Y" y está hecho de dos partes grandes llamadas cadenas pesadas y dos partes más pequeñas llamadas cadenas ligeras. Los anticuerpos son fabricados por un tipo de leucocito (glóbulo blanco) llamado linfocito B. Existen diferentes tipos de anticuerpos, cada uno con funciones distintas, que ayudan a nuestro cuerpo a defenderse de diferentes amenazas.
Aunque todos los anticuerpos tienen una estructura similar, una pequeña parte en la punta de la "Y" es muy diferente en cada uno. Esta parte se llama región hipervariable. Gracias a esta variación, existen millones de anticuerpos, cada uno capaz de unirse a una "diana" específica, que es lo que conocemos como antígeno. Esta gran variedad permite que nuestro sistema inmunitario reconozca muchísimos tipos de antígenos. Cuando un anticuerpo reconoce un antígeno, lo "marca" para que otras partes del sistema inmunitario lo ataquen. También pueden neutralizar directamente a los invasores, por ejemplo, uniéndose a una parte de un patógeno para que no pueda causar una infección.
La gran cantidad y diversidad de anticuerpos se crea combinando al azar diferentes partes de nuestros genes. Estos genes también pueden sufrir pequeños cambios que aumentan aún más la variedad. La producción de anticuerpos es una función clave de nuestro sistema inmunitario humoral.
Contenido
- ¿Qué son los anticuerpos y las inmunoglobulinas?
- ¿Cómo se presentan los anticuerpos?
- Tipos de anticuerpos
- ¿Cómo es la estructura de un anticuerpo?
- ¿Cómo funcionan los anticuerpos?
- ¿Cómo se logra la diversidad de los anticuerpos?
- Aplicaciones médicas de los anticuerpos
- Aplicaciones en la investigación científica
- Variantes de anticuerpos en medicina e investigación
- Galería de imágenes
- Véase también
¿Qué son los anticuerpos y las inmunoglobulinas?
En general, los términos "anticuerpo" e "inmunoglobulina" se usan para referirse a lo mismo. "Anticuerpo" describe su función (defender el cuerpo), mientras que "inmunoglobulina" se refiere a su estructura. El término "gammaglobulina" se usaba porque estas proteínas se movían de cierta manera en pruebas de laboratorio.
¿Quién descubrió los anticuerpos?
El estudio de los anticuerpos comenzó en 1890.
- Emil Adolf von Behring y Shibasaburo Kitasato descubrieron cómo los anticuerpos actuaban contra las toxinas de la difteria y el tétanos. Ellos propusieron que había algo en la sangre que podía reaccionar con sustancias extrañas, y lo llamaron anticuerpo.
- En 1897, Paul Ehrlich sugirió que las células tenían "receptores" en su superficie que se unían a las toxinas, como una "llave en una cerradura", y que esto activaba la producción de anticuerpos.
- En 1904, Almroth Wright propuso que los anticuerpos cubrían las bacterias para que otras células las "comieran" y destruyeran, un proceso llamado opsonización.
- En los años 1920, Michael Heidelberger y Oswald Avery confirmaron que los anticuerpos eran un tipo de proteínas.
- En 1948, Astrid Fagreaus descubrió que los células plasmáticas, que son un tipo de linfocito B, eran las encargadas de producir anticuerpos.
¿Cómo se descubrió la estructura de los anticuerpos?
Los científicos siguieron investigando para entender cómo eran los anticuerpos por dentro:
- A principios de los años 1960, Gerald M. Edelman y Joseph Gally descubrieron que los anticuerpos estaban formados por cadenas ligeras y pesadas unidas.
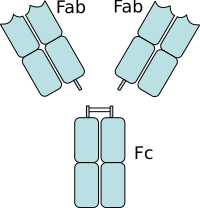
- Al mismo tiempo, Rodney Porter identificó las diferentes partes del anticuerpo: la región que se une al antígeno (Fab) y la "cola" (Fc).
- Por sus descubrimientos sobre la estructura de los anticuerpos, Edelman y Porter recibieron el Premio Nobel de fisiología y medicina en 1972.
- En los años 1960, se identificaron otros tipos de anticuerpos, como la IgA (descubierta por Thomas Tomasi), la IgD (por David Rowe y John Fahey), y la IgE (por Kikishige Ishizaka y Teruki Ishizaka), que está relacionada con las alergias.
- En 1975, César Milstein y Georges J. F. Köhler crearon un método para producir anticuerpos monoclonales, que son muy específicos.
¿Cómo se presentan los anticuerpos?
Los linfocitos B activados se convierten en células plasmáticas que producen anticuerpos solubles, o en linfocitos B de memoria que "recuerdan" el antígeno para futuras defensas. Los anticuerpos son esenciales para el sistema inmunitario adaptativo, que aprende y recuerda cómo combatir a los invasores. Los anticuerpos se encuentran de dos formas:
- Solubles: Flotan libremente en la sangre y otros líquidos del cuerpo.
- Anclados a la membrana: Se encuentran en la superficie de los linfocitos B.
Anticuerpos solubles
Los anticuerpos solubles son liberados por las células plasmáticas para unirse a sustancias extrañas y señalarlas para su destrucción. También se les llama "anticuerpos libres" hasta que se unen a un antígeno.
Anticuerpos anclados a la membrana
Los anticuerpos anclados a la membrana se llaman "inmunoglobulinas de superficie" (sIg) o "inmunoglobulinas de membrana" (mIg). No se secretan, sino que permanecen unidos a la membrana celular del linfocito B. Forman parte del receptor del linfocito B (BCR), que permite al linfocito B detectar la presencia de un antígeno específico y activarse. Un linfocito B humano puede tener entre 50.000 y 100.000 anticuerpos unidos a su superficie.
Tipos de anticuerpos
Los anticuerpos se presentan en diferentes variedades llamadas isotipos o clases. En los mamíferos, hay cinco isotipos principales: IgA, IgD, IgE, IgG e IgM. Se nombran con el prefijo "Ig" (de inmunoglobulina) y una letra. Cada tipo tiene propiedades y funciones biológicas distintas, y se encuentran en diferentes lugares del cuerpo.
| Nombre | Tipos | Descripción | Forma |
| IgA | 2 | Se encuentra en las mucosas (como el sistema digestivo y respiratorio), la saliva, las lágrimas y la leche. Ayuda a evitar que los patógenos se peguen a estas superficies. | 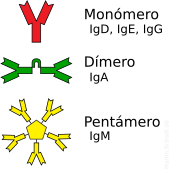 |
| IgD | 1 | Su función principal es actuar como receptor de antígenos en los linfocitos B que aún no han encontrado un antígeno. | |
| IgE | 1 | Se une a alérgenos y provoca la liberación de histamina, lo que causa las alergias. También protege contra algunos parásitos. | |
| IgG | 4 | Es el anticuerpo más abundante y proporciona la mayor parte de la protección contra los patógenos. Es el único anticuerpo que puede pasar de la madre al feto a través de la placenta, dándole inmunidad. | |
| IgM | 1 | Se encuentra en la superficie de los linfocitos B y también se secreta. Es muy eficaz para eliminar patógenos en las primeras etapas de una infección, antes de que haya suficientes IgGs. |
El tipo de anticuerpo que produce un linfocito B puede cambiar. Al principio, los linfocitos B "vírgenes" (que no han encontrado un antígeno) solo tienen IgM en su superficie. Cuando maduran, también expresan IgD. Una vez que un linfocito B se activa al unirse a su antígeno, puede cambiar el tipo de anticuerpo que produce (a IgE, IgA o IgG) para adaptarse mejor a la amenaza.
Alotipos
Los alotipos son pequeñas diferencias en la secuencia de aminoácidos de los anticuerpos entre diferentes personas de la misma especie. Estas diferencias se heredan.
Idiotipo
El idiotipo es una parte única de un anticuerpo que se encuentra cerca del lugar donde se une al antígeno. Es como la "huella digital" de un anticuerpo específico.
¿Cómo es la estructura de un anticuerpo?
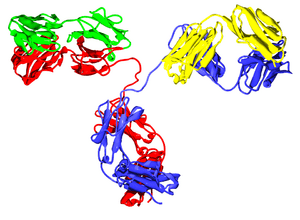
Los anticuerpos son proteínas grandes y pesadas. Tienen cadenas de azúcares unidas a ellos, lo que los convierte en glucoproteínas. La unidad básica de un anticuerpo es un monómero, que tiene una sola forma de "Y". Algunos anticuerpos pueden formar estructuras más grandes, como dímeros (dos unidades), tetrámeros (cuatro) o pentámeros (cinco), como la IgM.
Partes de un anticuerpo
Un anticuerpo monomérico tiene forma de "Y" y está compuesto por dos cadenas polipeptídicas: dos cadenas pesadas idénticas y dos cadenas ligeras idénticas, unidas por enlaces especiales. Cada cadena tiene partes llamadas "dominios Ig", que son como pequeños bloques de construcción.
Cadena pesada
Hay cinco tipos de cadenas pesadas en mamíferos (α, δ, ε, γ y μ), que definen la clase o isotipo del anticuerpo (IgA, IgD, IgE, IgG, e IgM). Las cadenas pesadas varían en tamaño. Las cadenas γ, α y δ tienen tres dominios constantes y una región flexible llamada "bisagra". Las cadenas μ y ε tienen cuatro dominios. La región variable de la cadena pesada es diferente en los anticuerpos producidos por distintos linfocitos B, pero es idéntica para todos los anticuerpos de un mismo linfocito B.
Cadena ligera
En mamíferos, hay dos tipos de cadena ligera: lambda (λ) y kappa (κ). Cada cadena ligera tiene un dominio constante y uno variable. Todos los anticuerpos de un mismo linfocito B tienen cadenas ligeras idénticas, y solo un tipo (κ o λ) está presente en un anticuerpo.
Regiones Fab y Fc
- Región Fab: Son los "brazos" de la "Y". Contienen el lugar que se une al antígeno y lo reconoce. Esta región está formada por partes variables y constantes de las cadenas ligera y pesada.
- Región Fc: Es la "base" o "tallo" de la "Y". Su función es interactuar con otras células del sistema inmunitario. Se une a receptores específicos en las células y a otras moléculas, como las del complemento, para asegurar que el anticuerpo genere la respuesta inmune adecuada.
¿Cómo funcionan los anticuerpos?
Los anticuerpos que circulan en la sangre son parte del sistema inmunitario humoral. Son producidos por linfocitos B que responden a un antígeno específico. Los anticuerpos ayudan a la inmunidad de tres maneras:
- Neutralización: Impiden que los patógenos entren en las células o las dañen, uniéndose a ellos.
- Opsonización: Marcan a los patógenos para que los macrófagos (células "comedoras") y otras células los eliminen.
- Activación del complemento: Desencadenan la destrucción directa del patógeno al activar el sistema del complemento, un grupo de proteínas que ayuda a destruir microbios.
Activación del complemento
Cuando los anticuerpos se unen a la superficie de un antígeno (por ejemplo, en una bacteria), atraen a las proteínas del sistema del complemento. Esto puede llevar a la muerte de la bacteria de dos formas: 1. Las moléculas del complemento, junto con el anticuerpo, marcan al microbio para que los fagocitos lo ingieran (opsonización). 2. Algunos componentes del complemento forman un "complejo de ataque a membrana" que ayuda a los anticuerpos a destruir la bacteria.
Activación de células efectoras
Los anticuerpos también pueden unir a varios patógenos, haciendo que se agrupen (aglutinación). Al cubrir al patógeno, los anticuerpos estimulan a otras células inmunitarias que tienen "receptores Fc" (que se unen a la región Fc del anticuerpo). Cuando un anticuerpo se une a un receptor Fc en una célula, esta célula realiza una función específica: los fagocitos "comen" al patógeno, las células cebadas liberan sustancias, y las células asesinas naturales liberan moléculas que destruyen al microbio.
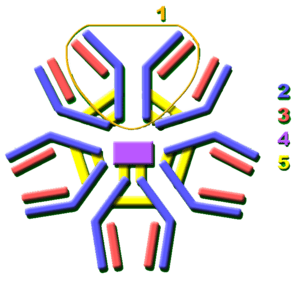
¿Cómo se logra la diversidad de los anticuerpos?
Casi todos los microorganismos pueden activar una respuesta de anticuerpos. Para reconocer y eliminar tantos tipos diferentes de invasores, los anticuerpos necesitan ser increíblemente diversos. Se calcula que los humanos podemos generar unos 10.000 millones de anticuerpos distintos, cada uno capaz de unirse a un antígeno diferente. Aunque tenemos un repertorio enorme de anticuerpos, el número de genes para fabricarlos es limitado. Los vertebrados han desarrollado mecanismos genéticos complejos para crear esta diversidad a partir de un número relativamente pequeño de genes de anticuerpos.
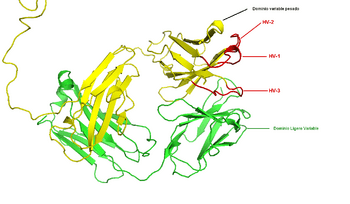
Variabilidad de dominios
La parte del cromosoma que codifica un anticuerpo es grande y contiene varios genes para cada parte del anticuerpo. Una de estas partes es el "dominio variable", que es diferente en los anticuerpos producidos por distintas líneas de linfocitos B. Las diferencias en los dominios variables se encuentran en tres bucles llamados regiones hipervariables (HV-1, HV-2 y HV-3). Al combinar estos genes con otros, se genera una gran cantidad de anticuerpos con mucha variabilidad.
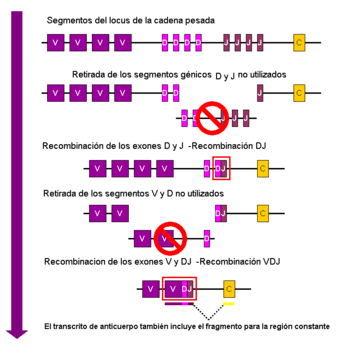
Recombinación V(D)J
La recombinación somática de las inmunoglobulinas, también conocida como Recombinación V(D)J, es un proceso que crea una región variable única para cada anticuerpo. La región variable de cada cadena pesada de inmunoglobulina está codificada por varias partes llamadas segmentos: variable (V), diversidad (D) y de unión (J). Las cadenas ligeras solo tienen segmentos V y J. En la médula ósea, cada linfocito B en desarrollo elige y combina al azar un segmento V, uno D y uno J (o V y J en la cadena ligera). Como hay muchas copias ligeramente diferentes de cada segmento, se forman muchísimas combinaciones, lo que genera una gran variedad de anticuerpos.
Hipermutación somática y maduración de la afinidad
Otro mecanismo que aumenta la diversidad de los anticuerpos ocurre en los linfocitos B maduros. Después de activarse por un antígeno, los linfocitos B se dividen rápidamente. Durante esta división, los genes de los dominios variables de los anticuerpos sufren muchas mutaciones puntuales en un proceso llamado hipermutación somática (SHM). Esto hace que cada célula hija tenga una ligera diferencia en la secuencia de aminoácidos de sus anticuerpos.
Algunas de estas mutaciones producen anticuerpos que se unen más débilmente a su antígeno, mientras que otras crean anticuerpos que se unen más fuertemente. Los linfocitos B con anticuerpos de alta afinidad (que se unen fuertemente) sobreviven mejor, mientras que los de baja afinidad mueren. Este proceso de generar anticuerpos con una afinidad cada vez mayor se llama maduración de la afinidad.
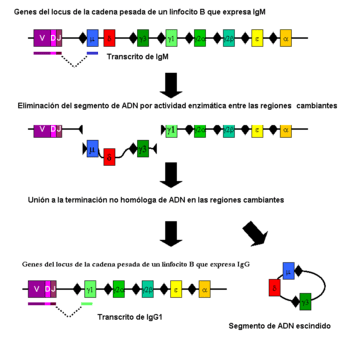
Cambio de clase
La conmutación de la clase de la inmunoglobulina es un proceso biológico que permite a los linfocitos B activados producir diferentes clases de anticuerpos (IgA, IgE o IgG). Al principio, los linfocitos B solo expresan IgM e IgD. Pero cada isotipo está diseñado para una función diferente. El cambio de clase permite que un solo linfocito B y sus descendientes produzcan anticuerpos de diferentes isotipos, manteniendo la misma especificidad para el antígeno. Solo cambia la región constante de la cadena pesada del anticuerpo, no la región variable que reconoce al antígeno.
Aplicaciones médicas de los anticuerpos
Diagnóstico de enfermedades
La detección de anticuerpos es muy común para diagnosticar enfermedades. Se realizan "pruebas serológicas" para buscar anticuerpos específicos en la sangre. Por ejemplo, si se buscan anticuerpos contra el virus de Epstein-Barr o la enfermedad de Lyme. Si no se encuentran, puede significar que la persona no está infectada o que la infección fue hace mucho tiempo.
También se miden los niveles de diferentes clases de inmunoglobulinas para entender el perfil de anticuerpos de un paciente. Por ejemplo, niveles altos de IgA pueden indicar cirrosis alcohólica, IgM alta puede sugerir hepatitis viral, y IgG alta puede verse en hepatitis viral o autoinmune.
Las enfermedades autoinmunes, donde el sistema inmunitario ataca al propio cuerpo, se pueden diagnosticar buscando anticuerpos que se unen a las propias células del organismo. La prueba de Coombs, por ejemplo, detecta anticuerpos contra los glóbulos rojos en la anemia hemolítica. Esta prueba también se usa antes de las transfusiones de sangre y en mujeres embarazadas.
Existen muchos métodos de diagnóstico basados en la detección de complejos antígeno-anticuerpo, como ELISA, inmunofluorescencia y Western blot, que se usan para diagnosticar enfermedades infecciosas.
Tratamientos terapéuticos
La terapia con anticuerpos monoclonales se usa para tratar enfermedades como la artritis reumatoide, esclerosis múltiple, psoriasis y muchos tipos de cáncer. Algunas inmunodeficiencias, donde hay una falta de anticuerpos, se tratan a veces con "inmunidad pasiva". Esto significa que se infunden anticuerpos "prefabricados" (de suero humano o animal) al paciente para darle una protección temporal.
Terapia prenatal
Las inmunoglobulinas anti-RhD se usan en el tratamiento prenatal para prevenir problemas en el embarazo cuando hay incompatibilidad Rh entre la madre y el bebé. Si una madre es Rh- y el bebé es Rh+, la sangre del bebé puede pasar a la madre durante el parto. Esto podría hacer que la madre desarrolle anticuerpos contra el factor Rh del bebé, lo que podría afectar futuros embarazos. Al administrar anticuerpos anti-RhD a la madre, estos destruyen los glóbulos rojos Rh+ del bebé en el cuerpo de la madre antes de que su sistema inmunitario pueda "recordar" el antígeno Rh y producir sus propios anticuerpos.
Aplicaciones en la investigación científica
En la investigación, los anticuerpos purificados se usan mucho para identificar y localizar proteínas dentro y fuera de las células. Se utilizan en técnicas como:
- Citometría de flujo: Para diferenciar tipos de células según las proteínas que expresan.
- Inmunoprecipitación: Para separar proteínas de otras moléculas.
- Western blot: Para identificar proteínas separadas por electroforesis.
- Inmunohistoquímica o inmunofluorescencia: Para ver la expresión de proteínas en tejidos o dentro de células usando un microscopio.
- ELISA y ELISPOT: Para detectar y medir la cantidad de proteínas.
Variantes de anticuerpos en medicina e investigación
A veces se necesitan anticuerpos muy específicos. Se pueden obtener de varias maneras:
- Anticuerpos policlonales: Se inyecta un antígeno en un animal (como un ratón, rata, conejo, cabra o caballo). La sangre de estos animales contiene muchos anticuerpos diferentes que se unen al mismo antígeno.
- Anticuerpos monoclonales: Si se necesita un anticuerpo que se una a un solo punto específico de un antígeno, se aíslan linfocitos de un animal y se fusionan con células cancerosas para que crezcan y produzcan anticuerpos en el laboratorio. Estos anticuerpos son todos idénticos.
- Anticuerpos de cadena sencilla: Son anticuerpos artificiales muy pequeños, hechos solo con las regiones variables de las cadenas ligera y pesada, unidas por un péptido. Se usan en técnicas de laboratorio.
- Abzimas: Son anticuerpos especiales que, además de reconocer antígenos, pueden actuar como enzimas (acelerar reacciones químicas). Se encuentran en pequeñas cantidades en personas sanas y se investigan para posibles usos terapéuticos e industriales.
- Nanoanticuerpos: Son anticuerpos muy pequeños de camélidos (como llamas o camellos), compuestos solo por dos cadenas pesadas. Su tamaño les permite llegar a lugares donde los anticuerpos normales no pueden, y se investiga su uso terapéutico.
- Faboterápicos: Son antídotos contra venenos de animales (como serpientes o artrópodos). Se fabrican usando solo la parte del anticuerpo que neutraliza el veneno (el fragmento F(ab')2), lo que reduce las reacciones alérgicas en los pacientes.
Galería de imágenes
-
Molécula de inmunoglobulina con su típica forma de Y.
Véase también
 En inglés: Antibody Facts for Kids
En inglés: Antibody Facts for Kids