Catálisis para niños
La catálisis es un proceso químico que hace que las reacciones químicas ocurran mucho más rápido. Esto sucede gracias a una sustancia especial llamada catalizador. Si una sustancia hace lo contrario, es decir, ralentiza o detiene la catálisis, se le llama inhibidor. Una cosa muy importante del catalizador es que su masa no cambia durante la reacción. Esto lo hace diferente de un reactivo, que sí se consume.
La catálisis es clave en la fabricación de muchos productos químicos importantes para la industria. Ayuda a que los procesos sean más rápidos y eficientes. A veces, los catalizadores pueden "envenenarse", lo que significa que pierden su capacidad de acelerar las reacciones. Aunque esto suele ser un problema, a veces se usa a propósito. Por ejemplo, para convertir etino en eteno, se usa un catalizador de paladio (Pd) que se "envenena" un poco con acetato de plomo (II). Así, el eteno no se convierte en etano después.
Contenido
- ¿Qué es la catálisis y por qué es importante?
- Características principales de los catalizadores
- Principios generales de la catálisis
- Tipos de catálisis
- La gran importancia de la catálisis
- Origen del término y su historia
- Inhibidores, venenos y promotores
- Diagramas de energía: visualizando la catálisis
- Más información sobre catálisis
- Véase también
¿Qué es la catálisis y por qué es importante?
La catálisis está presente en muchísimos procesos industriales. Además, la mayoría de las reacciones importantes en los seres vivos también son catalizadas. Investigar la catálisis es un campo muy activo en la ciencia aplicada. Involucra áreas como la química organometálica y la ciencia de materiales.
La catálisis también es fundamental para el medio ambiente. Un ejemplo es el convertidor catalítico de los coches, que ayuda a reducir la contaminación. También influye en cómo se forma el agujero de ozono. Las reacciones catalíticas son preferidas en la química verde porque generan menos residuos. El catalizador más común es el protón (H+). Muchos metales de transición y sus complejos se usan como catalizadores. Las enzimas son catalizadores biológicos muy importantes.
¿Cómo funciona un catalizador?
Un catalizador funciona ofreciendo un camino diferente para que una reacción ocurra. Este nuevo camino necesita menos energía de activación para empezar. Imagina que para subir una montaña (la reacción), el catalizador te da un túnel que la atraviesa, en lugar de tener que escalar hasta la cima. Así, la reacción ocurre más rápido.
Por ejemplo, el peróxido de hidrógeno (agua oxigenada) se descompone en agua y oxígeno:
- 2 H2O2 → 2 H2O + O2
Esta reacción es lenta por sí sola. Por eso, puedes comprar agua oxigenada y guardarla. Pero si le añades una pequeña cantidad de dióxido de manganeso, la reacción se acelera muchísimo. Verás burbujas de oxígeno. El dióxido de manganeso se puede recuperar sin cambios y usarlo una y otra vez. Por eso, decimos que el dióxido de manganeso cataliza esta reacción.
Características principales de los catalizadores
La característica principal de la catálisis es que la reacción catalizada necesita menos energía libre para llegar a su estado de transición. Esto significa que la reacción es más rápida a la misma temperatura. Sin embargo, la forma exacta en que un catalizador logra esto puede ser muy compleja.
Los catalizadores pueden mejorar el ambiente de la reacción. Por ejemplo, los catalizadores ácidos ayudan a que ciertos compuestos formen intermedios especiales que no se crearían de forma natural. También pueden ayudar a romper los reactivos en formas más activas, como el hidrógeno atómico en la hidrogenación catalítica.
Desde el punto de vista de la velocidad de las reacciones, las reacciones catalíticas se comportan como las reacciones normales. La velocidad depende de cuántas veces los reactivos chocan en la etapa más lenta de la reacción. Normalmente, el catalizador participa en esta etapa lenta, y la velocidad está limitada por la cantidad de catalizador disponible.
Aunque los catalizadores no se consumen, pueden perder su efectividad. Esto puede pasar si se cubren con otros productos (como el "coqueo" en la catálisis heterogénea) o si se disuelven o evaporan.
Principios generales de la catálisis
¿Cómo funciona un mecanismo catalítico típico?
Los catalizadores suelen reaccionar con uno o más de los elementos iniciales para formar productos intermedios. Estos intermedios luego se transforman en el producto final, y el catalizador se recupera. Aquí tienes un ejemplo sencillo:
- X + C → XC (1)
- Y + XC → XYC (2)
- XYC → CZ (3)
- CZ → C + Z (4)
Aquí, C es el catalizador, X e Y son los elementos iniciales, y Z es el producto final. Aunque el catalizador se usa en el paso 1, se recupera en el paso 4. Por eso, la reacción general es:
- X + Y → Z
Como el catalizador se regenera, solo se necesita una pequeña cantidad para acelerar mucho una reacción. Sin embargo, a veces los catalizadores se pierden o se dañan en otros procesos.
Un ejemplo real de esto se vio en 2008. Investigadores daneses observaron cómo el oxígeno y el hidrógeno se unen en la superficie del dióxido de titanio (un catalizador) para formar agua. Vieron que las moléculas se pegan a la superficie, se separan, se mueven y luego reaccionan.
Catálisis y la energía de las reacciones
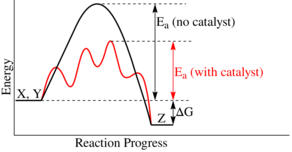
Los catalizadores funcionan creando un camino alternativo para la reacción, que tiene una energía de activación más baja. Esto significa que más moléculas tienen la energía suficiente para reaccionar. Así, los catalizadores permiten que las reacciones que serían muy lentas o imposibles ocurran a temperaturas más bajas.
Es importante saber que los catalizadores no cambian el resultado final de una reacción. No afectan el equilibrio químico. Esto se debe a que aceleran tanto la reacción hacia adelante como la reacción hacia atrás por igual. Si un catalizador pudiera cambiar el equilibrio, iría en contra de las leyes de la termodinámica.
La unidad para medir la actividad de un catalizador es el katal, que es moles por segundo. La eficiencia de un catalizador se puede describir por el "número de conversiones" (TON) y la "frecuencia de conversiones" (TOF). En biología, el equivalente es la unidad de actividad enzimática.
El catalizador hace que el estado de transición (el momento de mayor energía en la reacción) sea más estable. Esto reduce la diferencia de energía entre el inicio y el estado de transición, facilitando la reacción.
Materiales comunes que actúan como catalizadores
Los catalizadores pueden ser muy diferentes entre sí. Sin embargo, podemos hacer algunas generalizaciones. Los ácidos son muy usados, especialmente en reacciones que involucran agua. Los sólidos con varias funciones, como las zeolitas, la alúmina y algunas formas de carbono, también son catalizadores. Los metales de transición se usan a menudo para reacciones de reducción-oxidación (como la oxidación o la hidrogenación). Muchos procesos que usan hidrógeno necesitan metales del grupo del platino.
Algunos catalizadores son en realidad "precatalizadores". Esto significa que se convierten en el verdadero catalizador durante la reacción. Por ejemplo, el catalizador de Wilkinson se activa durante el proceso. Los precatalizadores son más fáciles de guardar y se activan justo cuando se necesitan.
Las sustancias que mejoran la actividad de un catalizador se llaman co-catalizadores o promotores.
Tipos de catálisis
Los catalizadores se clasifican en homogéneos o heterogéneos, dependiendo de si están en la misma fase (estado, como líquido o gas) que los elementos iniciales. Los biocatalizadores a menudo se consideran un grupo aparte.
Catalizadores enzimáticos: los ayudantes de la vida
Estos catalizadores son enzimas, que son proteínas especiales en los seres vivos. Se usan mucho en la industria, por ejemplo, en la farmacéutica para producir insulina usando una enzima de la bacteria E. coli.
Catalizadores heterogéneos: trabajando en diferentes fases
Los catalizadores heterogéneos están en una fase diferente a la de los elementos iniciales. La mayoría son sólidos que actúan sobre líquidos o gases. La superficie total del sólido es muy importante: cuanto más pequeña sea la partícula del catalizador, mayor será su superficie para una misma cantidad, y más rápida será la reacción.
Un ejemplo es el proceso de Haber, donde el hierro finamente dividido cataliza la producción de amoniaco a partir de nitrógeno e hidrógeno. Los gases se pegan a la superficie del hierro. Una vez pegados, los enlaces de las moléculas se debilitan, y se forman nuevos enlaces más rápido.
Los catalizadores heterogéneos a menudo se "soportan". Esto significa que el catalizador se dispersa sobre otro material que mejora su eficiencia o reduce su costo. A veces, el soporte es solo una superficie, pero otras veces interactúa con el catalizador, afectando la reacción.
Catalizadores homogéneos: mezclados en la misma fase
Los catalizadores homogéneos están disueltos en el mismo disolvente que los elementos iniciales. Un ejemplo es cómo el H+ ayuda en la formación de ésteres, como el acetato de metilo a partir de ácido acético y metanol.
Electrocatalizadores: impulsando reacciones eléctricas
En la electroquímica, especialmente en las pilas de combustible, se usan catalizadores metálicos para acelerar las reacciones eléctricas. Un tipo común es el platino en forma de nanopartículas sobre carbono. Este catalizador ayuda a que el oxígeno se convierta en agua en la pila de combustible.
Organocatálisis: catalizadores sin metales
Aunque los metales son muy conocidos como catalizadores, las moléculas orgánicas que no tienen metales también pueden ser catalíticas. Generalmente, se necesita más cantidad de estos catalizadores orgánicos, pero suelen ser más baratos y fáciles de conseguir. Las reacciones enzimáticas en la biología funcionan con principios de catálisis orgánica.
Nanocatálisis: el poder de lo pequeño
La nanocatálisis se basa en la idea de que los materiales catalíticos funcionan mejor cuando se usan a escala nanométrica (muy, muy pequeños), comparado con cuando se usan a un tamaño normal.
La gran importancia de la catálisis
Se calcula que el 90% de todos los productos químicos que se fabrican comercialmente usan catalizadores en algún momento. En 2005, los procesos catalíticos generaron productos por un valor de casi 900.000 millones de dólares en todo el mundo. La catálisis es tan común que es difícil clasificar todas sus aplicaciones.
Catálisis en la energía
El refinado de petróleo usa mucho la catálisis para procesos como el craqueo catalítico (romper hidrocarburos grandes en más pequeños) y el reformado con vapor (convertir hidrocarburos en gas de síntesis). Incluso los gases de escape de los coches se tratan con catalizadores. Los convertidores catalíticos, que suelen tener platino y rodio, transforman algunos gases dañinos en otros menos perjudiciales:
- 2 CO + 2 NO → 2 CO2 + N2
Para los combustibles sintéticos, un proceso importante es la síntesis de Fischer-Tropsch, que produce hidrocarburos a partir de gas de síntesis. El biodiésel y otros biocombustibles también necesitan catalizadores. Las pilas de combustible dependen de catalizadores para sus reacciones.
Productos químicos a gran escala
Muchos productos químicos se obtienen por oxidación catalítica, a menudo usando oxígeno. Ejemplos son el ácido nítrico y el ácido sulfúrico. Otros se producen por reducción, como el amoniaco (mediante el proceso de Haber) y el metanol.
Los plásticos como el etileno y el propileno se fabrican con catálisis Ziegler-Natta. Otros polímeros se obtienen con catálisis ácido-base.
Química fina y medicamentos
Muchos productos de química fina, incluyendo medicamentos, se preparan con catálisis. Se usan métodos de la industria pesada y otros más específicos. Un ejemplo es la producción de muchos compuestos quirales (con una forma específica) para fármacos.
Catálisis en los alimentos
Una aplicación clara es la hidrogenación de grasas usando níquel como catalizador para producir margarina. Muchos otros alimentos se preparan con biocatalizadores.
Catálisis en la biología
En la naturaleza, las enzimas son los catalizadores del metabolismo (procesos químicos en los seres vivos). La mayoría de los biocatalizadores son enzimas, pero otras moléculas biológicas también tienen propiedades catalíticas.
Los biocatalizadores se usan para fabricar productos químicos básicos, como el jarabe de maíz.
Catálisis y el medio ambiente
La catálisis ayuda al medio ambiente al hacer los procesos industriales más eficientes. También tiene un papel directo en la naturaleza. Un ejemplo es cómo los radicales libres catalizan la destrucción del ozono. Estos radicales se forman por la radiación ultravioleta sobre los clorofluorocarburos (CFC):
- Cl· + O3 → ClO· + O2
- ClO· + O· → Cl· + O2
Origen del término y su historia
En general, cualquier cosa que acelera un proceso es un "catalizador". La palabra viene del griego y significa "anular" o "desatar". La frase procesos catalizados fue creada por Jöns Jakob Berzelius en 1836. Él la usó para describir reacciones que se aceleran por sustancias que no cambian después de la reacción.
Otros químicos importantes en los inicios de la catálisis fueron Alexander Mitscherlich y Johann Wolfgang Döbereiner. Este último creó un encendedor que usaba hidrógeno y una esponja de platino, que fue un éxito en la década de 1820. Humphry Davy también descubrió el uso del platino en la catálisis. En la década de 1880, Wilhelm Ostwald investigó las reacciones catalizadas por ácidos y bases. Por su trabajo, Ostwald ganó el Premio Nobel de Química en 1909.
Inhibidores, venenos y promotores
Las sustancias que reducen la acción de los catalizadores se llaman inhibidores catalíticos (si el efecto es temporal) o venenos catalíticos (si el efecto es permanente). Los promotores son sustancias que aumentan la actividad del catalizador, aunque no sean catalizadores por sí mismos.
Un inhibidor puede cambiar no solo la velocidad, sino también qué productos se forman. Por ejemplo, para convertir etino en eteno, el catalizador de paladio se "envenena" un poco con acetato de plomo (II). Sin este "envenenamiento", el etileno se convertiría en etano, que no es el producto deseado.
Un inhibidor puede actuar cubriendo solo ciertos lugares activos del catalizador o cambiando la forma de su superficie.
Diagramas de energía: visualizando la catálisis
Este diagrama muestra cómo la energía de las moléculas cambia durante una reacción catalizada. Todas las moléculas tienen una cierta cantidad de energía, que depende de sus enlaces. Los elementos iniciales (A y B) tienen una energía, y los productos (AB) tienen otra.
Si la energía de los elementos iniciales es mayor que la de los productos, la reacción libera energía en forma de calor (es una reacción exotérmica). Si es al revés, la reacción necesita energía del exterior (es una reacción endotérmica).
Cuando las moléculas se acercan para reaccionar, su energía aumenta (el "pico" en el diagrama). Cuando se convierten en productos, se separan y se estabilizan.
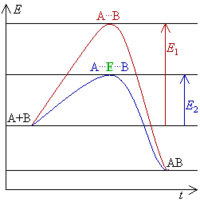
Las enzimas y otros catalizadores hacen que este "pico" de energía sea más bajo. Esto significa que se necesita menos energía para que la reacción ocurra. Como resultado, más moléculas pueden reaccionar, y la reacción es mucho más rápida. Un catalizador puede acelerar tanto las reacciones que liberan energía como las que la necesitan, porque en ambos casos hay que superar una barrera de energía. El catalizador (E) crea un ambiente donde A y B pueden alcanzar el estado intermedio (A...E...B) más fácilmente, reduciendo la energía necesaria (E2).
Los catalizadores no cambian el equilibrio final de la reacción.
Más información sobre catálisis
- Soporte catalítico
- Actividad enzimática
- Catalizador Lindlar
- Níquel Raney
- Reactor químico
Véase también
 En inglés: Catalysis Facts for Kids
En inglés: Catalysis Facts for Kids