Caseína para niños
La caseína (que viene de la palabra latina caseus, que significa «queso») es una proteína muy importante que se encuentra en la leche y en algunos productos hechos con ella, como el yogur o el queso. En la leche, la caseína se une al calcio y forma unas bolitas muy pequeñas llamadas micelas de caseína.
La cantidad de caseína varía según el tipo de leche. Por ejemplo, la leche humana tiene menos proteínas y menos caseína que la leche de vaca, oveja o cabra.
| Componente | Especie | |||
|---|---|---|---|---|
| Humana | Bovina | Ovina | Caprina | |
| Proteínas (% del total de la leche) | 1,3-1,5 | 3,2-3,5 | 5,4-6,0 | 3,1-4,0 |
| Caseínas (% del total de proteínas) | 44,9 | 82,5 | 84,8 | 81,3 |
Contenido
¿Qué hace especial a la caseína?
Las caseínas son un grupo de proteínas con características similares. Una de sus propiedades más importantes es que se separan del líquido (precipitan) cuando la leche se vuelve más ácida, alcanzando un nivel de acidez (pH) de 4,6. Por eso, a veces se les llama las "proteínas insolubles" de la leche.
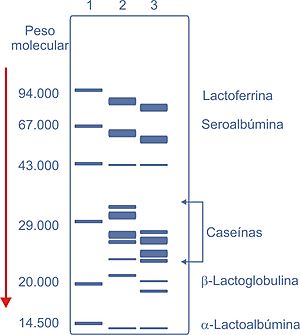
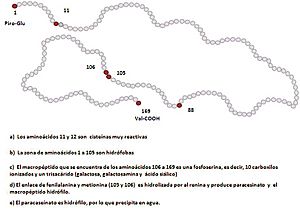
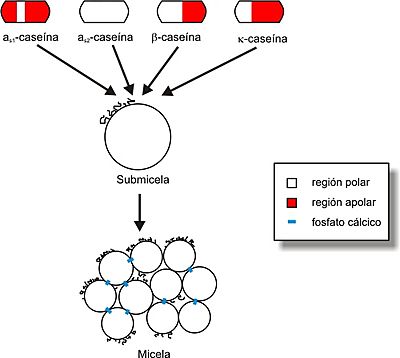
Aunque las caseínas son un poco diferentes en cada especie animal, se clasifican en grandes grupos: αs1-caseína, αs2-caseína, β-caseína y κ-caseína (mira la Figura 1). La κ-caseína es muy importante para hacer queso. Cuando se le añade una enzima especial llamada cuajo, esta caseína cambia y ayuda a que las micelas de caseína se unan y formen la cuajada del queso.
¿Cómo se comporta la caseína?
A diferencia de otras proteínas, la caseína no se altera fácilmente con el calor. Esto se debe a que tiene mucha prolina, un tipo de aminoácido que le da una estructura flexible.
Cuando la leche se vuelve ácida, las micelas de caseína pierden su carga eléctrica y se agrupan. Este proceso es lo que ocurre cuando se hace yogur. En la industria, a la caseína que se obtiene así se le llama caseína ácida. En la fabricación de quesos, la coagulación puede ser por acidez o por enzimas, o una combinación de ambas.
Las caseínas son un poco hidrofóbicas, lo que significa que no se mezclan muy bien con el agua.
Un dato interesante es que el punto isoeléctrico promedio de la caseína es 4,6. En este nivel de acidez, la caseína es menos soluble y por eso se agrupa y precipita.
| Característica | Caseína | |||
|---|---|---|---|---|
| αs1 | αs2 | β | κ | |
| Cantidad en leche (g/L) | 12-15 | 3-4 | 9-11 | 2-4 |
| Masa molecular | 23.545 - 23.615 | 25.226 | 23.983 - 24.023 | 19.006 - 19.037 |
| Punto isoeléctrico (pI) | 4,44 - 4,76 | ... | 4,83 - 5,07 | 5,45 - 5,77 |
| Aminoácidos (n.º) | 199 | 207 | 209 | 169 |
¿Cómo se organizan las caseínas?
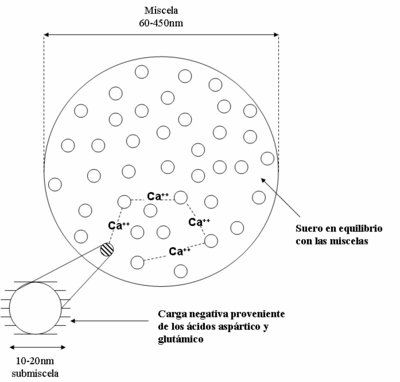
Las caseínas se unen entre sí para formar unas partículas esféricas llamadas micelas (mira la Figura 3). Estas micelas son muy pequeñas, miden entre 60 y 450 nanómetros (un nanómetro es una milmillonésima parte de un metro).
Se cree que las micelas están formadas por unidades más pequeñas llamadas "submicelas" (mira la Figura 4), que miden entre 10 y 20 nanómetros. Estas submicelas se unen gracias a los iones de calcio. La κ-caseína es muy importante para mantener estables estas micelas y evitar que se separen, especialmente por la acción del calcio o de algunas enzimas.
¿Para qué se usa la caseína?
La caseína tiene muchos usos, tanto en la alimentación como en la industria.
En la alimentación
La caseína se usa como un tipo de pegamento natural en la elaboración de muchos alimentos, como productos lácteos, cárnicos, panes y dulces.
También es muy útil en la alimentación especial, por ejemplo, para hacer preparados médicos o concentrados de proteínas para deportistas. Se ha visto que la caseína se digiere más lentamente que otras proteínas de la leche, lo que la hace ideal para ayudar a los músculos a recuperarse después del ejercicio.
El yogur es una fuente natural de caseína. Durante el proceso de fermentación del yogur, las bacterias hacen que la leche se vuelva ácida, lo que provoca que la caseína se coagule y le dé al yogur su textura espesa y característica.
En la industria
La caseína también se usa en la fabricación de pegamentos, pinturas, cubiertas protectoras y plásticos.
| Producto | Propiedad | Aplicación |
|---|---|---|
| Envoltura |
|
|
| Adhesivo |
|
|
| Plástico |
|
|
| Surfactante |
|
|
También se utiliza para clarificar vinos o como ingrediente en preparados para estudiar biología molecular y microbiología, como en los medios de cultivo para hacer crecer microorganismos.
Galería de imágenes
Véase también
 En inglés: Casein Facts for Kids
En inglés: Casein Facts for Kids