Enzima para niños
Las enzimas son como pequeños trabajadores especiales en nuestro cuerpo y en todos los seres vivos. Son biomoléculas, la mayoría de ellas proteínas, que ayudan a que las reacciones químicas necesarias para la vida ocurran mucho más rápido. Imagina que son como catalizadores, es decir, aceleran los procesos sin cambiarse a sí mismas.
Las enzimas son muy importantes porque sin ellas, muchas reacciones en nuestras células serían tan lentas que la vida no sería posible. Actúan sobre unas moléculas llamadas sustratos, transformándolas en productos. Todas las rutas metabólicas (los caminos químicos) en las células necesitan enzimas para funcionar bien.
Las enzimas son muy específicas, como una llave que solo abre una cerradura. Esto significa que cada enzima suele trabajar con un tipo específico de sustrato y para una reacción en particular. Gracias a esta especificidad, el conjunto de enzimas en una célula determina cómo funciona su metabolismo.
Como todos los catalizadores, las enzimas hacen que las reacciones sean más rápidas al reducir la energía de activación (la energía inicial necesaria para que una reacción comience). No cambian el resultado final de la reacción, solo la velocidad a la que se llega a ese resultado, ¡a veces millones de veces más rápido!
La actividad de las enzimas puede ser afectada por otras moléculas. Algunas moléculas, llamadas inhibidores, pueden disminuir o detener la actividad de una enzima. Otras, llamadas activadores, la aumentan. También, la temperatura, el pH (qué tan ácida o básica es una sustancia) y la cantidad de enzima o sustrato pueden influir en su trabajo.
Las enzimas se usan mucho en la industria, por ejemplo, para fabricar antibióticos, productos de limpieza, alimentos y hasta biocombustibles.
Contenido
- Historia de las enzimas
- Cómo funcionan las enzimas
- Cofactores y coenzimas
- Termodinámica de las enzimas
- Cómo se mide la actividad de las enzimas
- Inhibición de enzimas
- Funciones biológicas de las enzimas
- Control de la actividad enzimática
- Enzimas y enfermedades
- Clasificación y nombres de las enzimas
- Aplicaciones industriales de las enzimas
- Galería de imágenes
- Véase también
Historia de las enzimas
Desde hace mucho tiempo, la gente sabía que el estómago podía digerir la carne y que las plantas podían convertir el almidón en azúcar. Pero no sabían cómo ocurría esto. La primera enzima fue descubierta en 1833 por Anselme Payen y Jean-François Persoz.
En el siglo XIX, el científico Louis Pasteur estudió cómo la levadura convertía el azúcar en alcohol. Él pensó que esta fermentación era causada por algo vivo dentro de las células de la levadura.
En 1878, el fisiólogo Wilhelm Kühne creó la palabra "enzima", que viene del griego y significa "en levadura", para describir este proceso.
Más tarde, en 1897, Eduard Buchner descubrió que los extractos de levadura podían fermentar el azúcar incluso sin células vivas. Esto demostró que las enzimas podían funcionar fuera de un organismo. Por este descubrimiento, Buchner ganó el Premio Nobel de Química en 1907.
Después de Buchner, se empezó a nombrar a las enzimas añadiendo el sufijo "-asa" al nombre de la sustancia sobre la que actúan. Por ejemplo, la lactasa es la enzima que descompone la lactosa.
En 1926, James B. Sumner demostró que las enzimas eran proteínas puras. Más tarde, John Howard Northrop y Wendell Meredith Stanley confirmaron esto con otras enzimas. Los tres recibieron el Premio Nobel de Química en 1946.
En 1965, se logró ver la estructura de una enzima, la lisozima, usando cristalografía y difracción de rayos X. Esto ayudó a entender cómo funcionan las enzimas a nivel molecular.
Cómo funcionan las enzimas
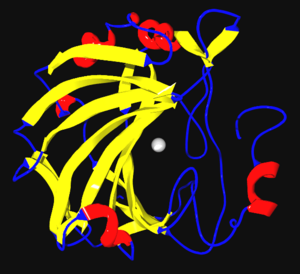
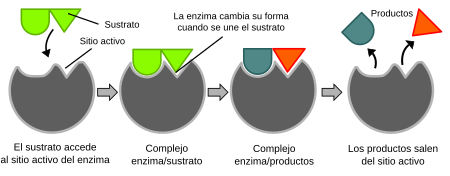
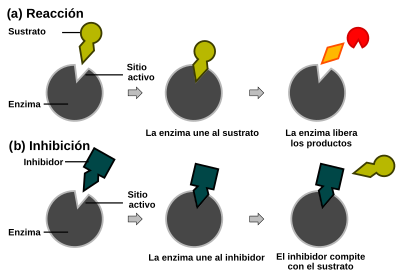
Las enzimas son generalmente proteínas con formas complejas. Aunque son grandes, solo una pequeña parte de ellas es la que realmente hace el trabajo. Esta parte se llama centro activo o sitio activo. Es aquí donde el sustrato se une a la enzima.
La forma de una enzima es clave para su función. Si la forma cambia, la enzima podría dejar de funcionar correctamente.
Especificidad de las enzimas
Las enzimas son muy específicas. Esto significa que cada enzima suele catalizar un solo tipo de reacción y actúa sobre un sustrato específico. La forma y las características de la enzima y el sustrato son las que permiten esta especificidad.
Algunas enzimas, como las que trabajan en la copia y expresión del genoma, son increíblemente precisas. Tienen sistemas para revisar y corregir errores, asegurando que el ADN se copie casi perfectamente.
Modelos de acción enzimática
Modelo de la «llave-cerradura»
En 1894, Emil Fischer propuso el modelo de la "llave-cerradura". Él pensó que la enzima y el sustrato encajan perfectamente, como una llave en su cerradura. Este modelo explica por qué las enzimas son tan específicas. Una llave solo abre su cerradura, no cualquier otra.
Modelo del encaje inducido
En 1958, Daniel Koshland sugirió una mejora al modelo anterior. Él dijo que las enzimas no son rígidas, sino que son flexibles. Cuando el sustrato se une a la enzima, el sitio activo de la enzima puede cambiar ligeramente su forma para ajustarse mejor al sustrato. Es como un guante que se adapta a la mano. Este cambio de forma ayuda a la enzima a realizar su trabajo.
Cómo aceleran las reacciones
Las enzimas aceleran las reacciones de varias maneras:
- Estabilizando el estado de transición: Ayudan a que el sustrato alcance una forma intermedia (el estado de transición) que necesita menos energía para convertirse en producto.
- Creando un ambiente ideal: Proporcionan un lugar con las cargas eléctricas adecuadas para que la reacción ocurra más fácilmente.
- Ofreciendo un camino alternativo: A veces, la enzima se une temporalmente al sustrato, formando un complejo intermedio que facilita la reacción.
- Orientando los sustratos: Colocan los sustratos en la posición correcta para que reaccionen entre sí.
Efecto de la temperatura
La temperatura afecta la actividad de las enzimas. Un aumento de temperatura generalmente acelera la reacción. Sin embargo, si la temperatura es demasiado alta, la enzima puede "desnaturalizarse", es decir, perder su forma y, por lo tanto, su función. Es como si se derritiera y ya no pudiera trabajar. Algunas enzimas funcionan mejor a temperaturas bajas.
Modulación alostérica
Algunas enzimas tienen "sitios alostéricos", que son lugares diferentes al sitio activo donde otras moléculas pueden unirse. Cuando una molécula se une a un sitio alostérico, puede cambiar la forma de la enzima y así activar o desactivar su actividad. Es una forma importante de controlar las enzimas en las células.
Cofactores y coenzimas
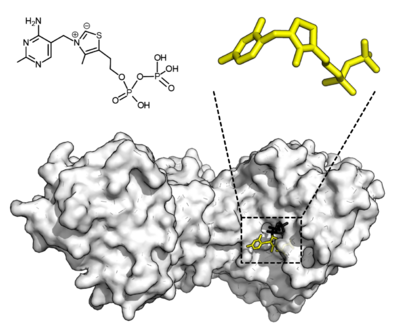
Algunas enzimas necesitan ayuda extra para funcionar. Estas ayudas son moléculas no proteicas llamadas cofactores. Los cofactores pueden ser iones metálicos (como el zinc) o compuestos orgánicos.
Los cofactores orgánicos se llaman coenzimas. Las coenzimas son pequeñas moléculas que transportan grupos químicos de una enzima a otra. Muchas vitaminas, como la riboflavina o la tiamina, son coenzimas o forman parte de ellas. Por ejemplo, el NADH y el ATP son coenzimas muy importantes que transfieren energía o grupos químicos.
Las enzimas que necesitan un cofactor pero no lo tienen se llaman "apoenzimas". Cuando la apoenzima se une a su cofactor, se convierte en una "holoenzima", que es la forma activa y lista para trabajar.
Las coenzimas se reciclan constantemente en la célula. Por ejemplo, nuestro cuerpo usa su propio peso en ATP cada día, pero lo regenera continuamente.
Termodinámica de las enzimas
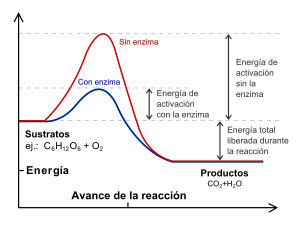
Las enzimas no cambian el equilibrio final de una reacción química, solo la hacen más rápida. Si una reacción va en una dirección sin enzima, con la enzima seguirá yendo en la misma dirección, pero mucho más rápido.
A veces, las enzimas pueden unir dos o más reacciones. Esto es útil cuando una reacción que necesita energía se combina con otra que libera energía, como la hidrólisis del ATP, para que la primera pueda ocurrir.
Las enzimas pueden catalizar reacciones en ambas direcciones, dependiendo de la cantidad de los reactivos. Por ejemplo, la anhidrasa carbónica puede formar o descomponer el dióxido de carbono y el agua, según lo que haya más en el ambiente.
Cómo se mide la actividad de las enzimas
El estudio de cómo las enzimas se unen a sus sustratos y los transforman en productos se llama cinética enzimática.
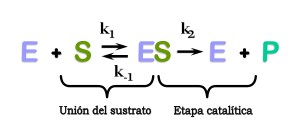
En 1902, Victor Henri propuso una teoría sobre cómo funcionan las enzimas, y más tarde, en 1913, Leonor Michaelis y Maud Leonora Menten la confirmaron. Su trabajo es la base de lo que hoy conocemos como la cinética de Michaelis-Menten.
La idea principal es que la reacción enzimática ocurre en dos pasos: 1. El sustrato se une a la enzima, formando un complejo enzima-sustrato. 2. La enzima transforma el sustrato en producto y lo libera.
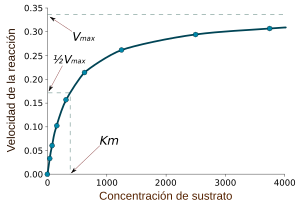
Las enzimas pueden catalizar millones de reacciones por segundo. Su velocidad depende de las condiciones (temperatura, pH) y de la cantidad de sustrato. Si hay mucho sustrato, la enzima se "satura" y trabaja a su máxima velocidad (llamada Vmax). Esto ocurre cuando todos los sitios activos de la enzima están ocupados por el sustrato.
Otro valor importante es la Km, que indica la concentración de sustrato necesaria para que la enzima alcance la mitad de su velocidad máxima. Este valor nos dice qué tan bien se une el sustrato a la enzima.
Algunas enzimas son tan eficientes que se les llama "enzimas catalíticamente perfectas". Esto significa que cada vez que la enzima se encuentra con su sustrato, la reacción ocurre.
Inhibición de enzimas
Los inhibidores son moléculas que cambian la actividad de las enzimas, generalmente disminuyéndola. Pueden ser:
- Irreversibles: Se unen a la enzima de forma permanente, desactivándola. Algunos medicamentos, como la aspirina, funcionan así.
- Reversibles: Se unen temporalmente a la enzima y pueden soltarse. Hay varios tipos:
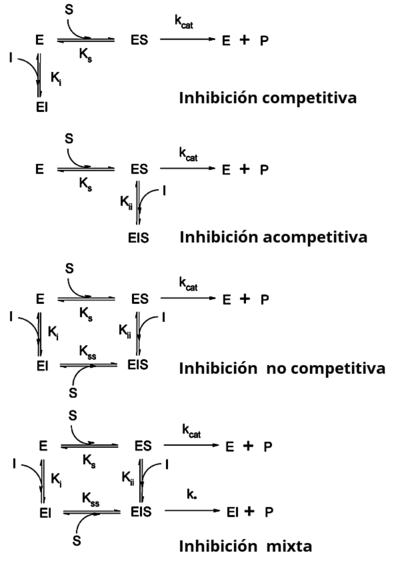
* Inhibición competitiva: El inhibidor y el sustrato compiten por el mismo sitio activo de la enzima. Si hay mucho inhibidor, el sustrato no puede unirse. Un ejemplo es el metotrexato, un medicamento que se parece al ácido fólico y compite con él por la enzima. Si aumentas la cantidad de sustrato, puedes superar este tipo de inhibición. * Inhibición acompetitiva: El inhibidor solo se une a la enzima cuando el sustrato ya está unido. * Inhibición no competitiva: El inhibidor se une a la enzima en un lugar diferente al sitio activo, pero aun así reduce la actividad de la enzima. La cantidad de inhibición no depende de la cantidad de sustrato. * Inhibición mixta: El inhibidor puede unirse a la enzima con o sin el sustrato, y afecta la unión del sustrato.
En los organismos, los inhibidores a menudo forman parte de un sistema de control. Si una enzima produce demasiado de una sustancia, esa misma sustancia puede actuar como inhibidor de la enzima, deteniendo su propia producción. Esto es como un sistema de "retroalimentación negativa" que ayuda a mantener el equilibrio en el cuerpo.
- Usos de los inhibidores
Los inhibidores enzimáticos son muy importantes en la medicina. Muchos fármacos son inhibidores que ayudan a tratar enfermedades. Por ejemplo, la aspirina inhibe enzimas que causan dolor e inflamación. Sin embargo, algunos inhibidores también pueden ser venenos, como el cianuro, que bloquea una enzima vital para la respiración celular en animales.
Funciones biológicas de las enzimas
Las enzimas tienen muchísimas funciones en los seres vivos:
- Comunicación celular: Ayudan a las células a enviarse señales entre sí.
- Movimiento: La miosina es una enzima que ayuda a los músculos a contraerse.
- Transporte: Algunas enzimas en la membrana celular (como las "bombas de iones") mueven sustancias dentro y fuera de la célula.
- Producción de luz: En las luciérnagas, la luciferasa produce luz.
- Defensa: Los virus tienen enzimas que les ayudan a infectar células.
- Digestión: En nuestro sistema digestivo, enzimas como las amilasas y proteasas descomponen los alimentos grandes (como el almidón y las proteínas) en moléculas más pequeñas que pueden ser absorbidas por el intestino.
Varias enzimas pueden trabajar juntas en una secuencia, formando una ruta metabólica. En estas rutas, el producto de una enzima se convierte en el sustrato de la siguiente. Las enzimas son esenciales para que estas rutas funcionen a la velocidad necesaria para la vida.
Control de la actividad enzimática
La actividad de las enzimas se controla de varias maneras en las células:
- Producción de la enzima: La célula puede decidir si produce más o menos de una enzima, según lo que necesite. Por ejemplo, algunas bacterias pueden volverse resistentes a los antibióticos produciendo enzimas que los destruyen.
- Localización: Las enzimas pueden estar en diferentes partes de la célula, lo que permite que distintas reacciones ocurran de forma independiente.
- Inhibidores y activadores: Como ya vimos, otras moléculas pueden encender o apagar las enzimas. Esto es clave para la homeostasis (mantener el equilibrio interno del cuerpo).
- Modificaciones: Las enzimas pueden ser modificadas después de su creación, lo que cambia su actividad. Por ejemplo, la insulina hace que muchas enzimas se modifiquen para controlar los niveles de azúcar en la sangre. Algunas enzimas se producen inactivas y solo se activan cuando llegan a su lugar de trabajo, como las enzimas digestivas que se activan en el estómago para no dañar el páncreas.
- Activación por el ambiente: Algunas enzimas se activan cuando cambian de un ambiente a otro, por ejemplo, de un pH alto a uno bajo.
Enzimas y enfermedades
Como el control de las enzimas es tan importante, cualquier problema en una enzima clave puede causar una enfermedad genética. A veces, un pequeño cambio en una sola enzima puede tener consecuencias graves.
Un ejemplo es la fenilcetonuria, una enfermedad donde una enzima llamada fenilalanina hidroxilasa no funciona bien. Esto hace que se acumulen sustancias dañinas en el cuerpo, lo que puede causar problemas de desarrollo cerebral si no se trata.
Otro ejemplo son las enfermedades hereditarias donde las enzimas encargadas de reparar el ADN no funcionan. Esto lleva a que se acumulen errores en el ADN, lo que puede aumentar el riesgo de desarrollar ciertos tipos de cáncer.
Clasificación y nombres de las enzimas
Las enzimas suelen nombrarse según la sustancia sobre la que actúan (el sustrato) o el tipo de reacción que catalizan, y casi siempre terminan en "-asa". Por ejemplo, la lactasa actúa sobre la lactosa, y la ADN polimerasa ayuda a formar ADN.
Existe un sistema de clasificación internacional para las enzimas, llamado código EC. Es un número de cuatro cifras que indica el tipo de reacción que catalizan. Hay siete clases principales de enzimas:
- EC 1 Oxidorreductasas: Ayudan en reacciones donde se transfieren electrones. Ejemplos: deshidrogenasas.
- EC 2 Transferasas: Mueven grupos químicos de una molécula a otra. Ejemplos: transaminasas.
- EC 3 Hidrolasas: Rompen moléculas grandes usando agua. Son importantes en la digestión. Ejemplos: lipasas.
- EC 4 Liasas: Añaden o quitan grupos de moléculas para formar o romper dobles enlaces. Ejemplos: descarboxilasas.
- EC 5 Isomerasas: Cambian la forma de una molécula para convertirla en un isómero diferente. Ejemplos: epimerasas.
- EC 6 Ligasas: Unen dos moléculas usando energía. Ejemplos: sintetasas.
- EC 7 Translocasas: Mueven sustancias a través de las membranas celulares. Ejemplo: citocromo-c oxidasa.
Aplicaciones industriales de las enzimas
Las enzimas se usan mucho en la industria química y en otras industrias porque son catalizadores muy específicos. Los científicos están trabajando para crear enzimas con nuevas propiedades para usos aún más diversos.
Aquí tienes una tabla con algunas aplicaciones industriales de las enzimas:
| Aplicación | Enzimas utilizadas | Usos |
| Procesado de alimentos | Amilasas de hongos y plantas. | Producen azúcares a partir del almidón, como en el jarabe de maíz. En la panadería, rompen el almidón de la harina en azúcar, que la levadura usa para hacer que la masa "suba". |
| Proteasas | Los fabricantes de galletas las usan para reducir la cantidad de proteínas en la harina. | |
| Alimentos para bebés | Tripsina | Para pre-digerir los alimentos para bebés. |
Elaboración de cerveza

Cebada germinada usada para hacer malta.
|
Enzimas de la cebada liberadas durante el proceso de malteado. | Descomponen el almidón y las proteínas en azúcares simples, aminoácidos y péptidos que las levaduras usan para la fermentación. |
| Enzimas de cebada producidas industrialmente | Se usan para reemplazar las enzimas naturales de la cebada. | |
| Amilasa, glucanasa y proteasas | Digieren polisacáridos y proteínas en la malta. | |
| Betaglucanasas y arabinoxilanasas | Mejoran la filtración del mosto y la cerveza. | |
| Amiloglucosidasas y pululanasas | Producen cerveza baja en calorías y ajustan la fermentación. | |
| Proteasas | Eliminan la turbidez que puede aparecer en la cerveza almacenada. | |
| Acetolactatodecarboxilasa (ALDC) | Aumenta la eficiencia de la fermentación. | |
| Jugos de frutas | Celulasas, pectinasas | Aclaran los jugos de frutas. |
| Industria láctea | Renina, de estómagos de animales jóvenes. | Se usa en la producción de queso para descomponer proteínas. |
| Enzimas producidas por bacterias | Cada vez más usadas en la industria láctea. | |
| Lipasas | Se añaden durante la producción del queso Roquefort para ayudar a su maduración. | |
| Lactasas | Descomponen la lactosa en glucosa y galactosa. | |
| Digestión de carne | Papaína | Ablanda la carne para cocinar. |
| Industria del almidón | Amilasas, amiloglucosidasas y glucoamilasas | Convierten el almidón en glucosa y otros azúcares. |
| Glucosa isomerasa | Convierte la glucosa en fructosa para producir jarabe de maíz con alto contenido de fructosa, que es más dulce y puede reducir calorías. | |
Industria del papel

Una fábrica de papel en Carolina del Sur.
|
Amilasas, xilanasas, celulasas y ligninasas | Descomponen el almidón para reducir su viscosidad. Las xilanasas reducen la necesidad de blanqueador; las celulasas alisan las fibras y ayudan a eliminar tintas; las lipasas reducen la oscuridad y las ligninasas ablandan el papel. |
| Industria del biocombustible | Celulasas | Descomponen la celulosa en azúcares que pueden fermentarse. |
| Ligninasas | Eliminan residuos de lignina. | |
| Detergentes biológicos | Principalmente proteasas, producidas por bacterias. | Ayudan a eliminar manchas de proteínas de la ropa. |
| Amilasas | En Detergentes para lavadoras para eliminar manchas de almidón. | |
| Lipasas | Ayudan a eliminar manchas de grasa y aceite. | |
| Celulasas | Se usan en suavizantes biológicos. | |
| Limpiadores de lentes de contacto | Proteasas | Eliminan restos de proteínas de las lentes de contacto para prevenir infecciones. |
| Industria del hule | Catalasa | Genera oxígeno a partir de peróxido para convertir el látex en hule espumoso. |
| Industria fotográfica | Proteasa (ficina) | Disuelve la gelatina de las películas fotográficas usadas para recuperar la plata. |
| Biología molecular | Enzimas de restricción, ADN ligasa y polimerasas | Se usan para manipular el ADN en ingeniería genética. Son muy importantes en farmacología, agricultura y medicina. |
Galería de imágenes
Véase también
 En inglés: Enzyme Facts for Kids
En inglés: Enzyme Facts for Kids