Hidrólisis para niños
La hidrólisis es una reacción química donde el agua juega un papel muy importante. La palabra viene del griego: "hydro" significa 'agua' y "lysis" significa 'ruptura' o 'separación'. Así, la hidrólisis es un proceso en el que el agua ayuda a romper una molécula grande en partes más pequeñas.
En la química, esto puede significar que el agua cambia las propiedades de algunas sustancias, como las sales, o que rompe los enlaces de una molécula, creando nuevas sustancias. En la química orgánica, que estudia las moléculas de los seres vivos y las que contienen carbono, la hidrólisis se usa para reacciones donde el agua ayuda a dividir una molécula.
Esta reacción es muy común porque el agua es un disolvente (una sustancia que disuelve otras) muy abundante.
En la biología, la hidrólisis es fundamental. Por ejemplo, cuando un carbohidrato (como el azúcar) se descompone en sus azúcares más simples (como la glucosa y la fructosa), el agua es la que ayuda a separarlos. A este proceso se le llama sacarificación.
Las reacciones de hidrólisis son lo contrario de las reacciones de condensación. En la condensación, dos moléculas se unen y liberan una molécula de agua. En cambio, en la hidrólisis, el agua se añade para romper una molécula.
Contenido
¿Cómo funciona la hidrólisis ácido-base?
En este tipo de hidrólisis, el agua se divide en dos partes: un ion hidroxilo (OH-) y un ion H+. Este ion H+ se une rápidamente a otra molécula de agua para formar el ion hidronio (H3O+). Esto ocurre de forma natural en el agua pura.
Cuando se añade una sal al agua, los iones de la sal pueden unirse a los iones hidronio o hidroxilo del agua. Esto cambia la cantidad de estos iones en el agua y, como resultado, el valor del pH (que indica si una sustancia es ácida, básica o neutra) se modifica.
Por ejemplo, si una sal proviene de un ácido o una base que no son muy fuertes, sus iones pueden reaccionar con el agua y cambiar el pH. Si la sal viene de ácidos o bases muy fuertes, la hidrólisis es mínima y el pH casi no cambia.
Hidrólisis en la química orgánica
En la química orgánica, la hidrólisis es la reacción opuesta a la condensación. Aquí, una molécula orgánica y el agua reaccionan para romper un enlace covalente (un tipo de unión entre átomos). Esto forma dos moléculas orgánicas nuevas que incorporan los átomos del agua. Para que esta reacción ocurra más rápido, a menudo se necesita añadir ácidos o bases fuertes que actúan como catalizadores (sustancias que aceleran las reacciones sin consumirse).
Hidrólisis de amidas y ésteres
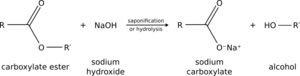
La hidrólisis de las amidas y los ésteres sucede cuando el agua o un ion hidróxido atacan una parte específica de estas moléculas. En un ambiente con una base, los iones hidróxido son más efectivos que el agua. En un ambiente ácido, la molécula se prepara para ser atacada más fácilmente.
Cuando una amida se hidroliza, se convierte en un ácido carboxílico y una amina (o amoníaco). Si un éster se hidroliza, se forma un ácido carboxílico y un alcohol.
Un ejemplo muy antiguo de hidrólisis es la saponificación, que es el proceso para hacer jabón. En este caso, la hidrólisis de una grasa (que tiene grupos éster) con una base produce glicerol (un alcohol) y ácidos grasos. Estos ácidos reaccionan con la base para formar las sales orgánicas que conocemos como jabones.
En los seres vivos, muchas reacciones de hidrólisis son ayudadas por enzimas. Las enzimas son como pequeñas máquinas que aceleran las reacciones. Por ejemplo, las proteasas son enzimas que ayudan a la digestión rompiendo los enlaces de las proteínas en el cuerpo. Estas enzimas son muy específicas y solo actúan sobre ciertas proteínas que tienen una forma particular, como una llave que solo encaja en una cerradura. Esto es importante para que otras proteínas, como las hormonas, no se rompan y el cuerpo funcione correctamente.
Después de la hidrólisis, una amida se transforma en un ácido carboxílico y una amina. La hidrólisis de los péptidos (que forman las proteínas) produce aminoácidos.
Algunos materiales como el nailon 6,6 (un tipo de polímero de poliamida) pueden romperse por hidrólisis si se exponen a ácidos fuertes. Esto hace que el material se debilite y se fracture. Los poliésteres también pueden sufrir un proceso similar.
Hidrólisis del ATP
La hidrólisis es clave para cómo las células vivas obtienen y usan la energía. Todas las células necesitan energía para construir moléculas y para mover sustancias a través de sus membranas. La energía que las células obtienen de los alimentos no se usa directamente, sino que se almacena en una molécula especial llamada trifosfato de adenosina (ATP).
La molécula de ATP tiene enlaces que liberan energía cuando se rompen. El ATP puede hidrolizarse de dos maneras:
- La primera forma es cuando se rompe un fosfato del ATP, formando difosfato de adenosina (ADP) y fosfato inorgánico.
- La segunda forma es cuando se rompen dos fosfatos del ATP, formando monofosfato de adenosina (AMP) y pirofosfato. Este último se rompe aún más en dos fosfatos.
Estas reacciones de hidrólisis liberan la energía necesaria para que la célula realice sus funciones vitales.
Hidrólisis de polisacáridos
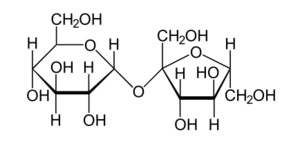
Los monosacáridos (azúcares simples) pueden unirse entre sí mediante enlaces especiales llamados glucosídicos. Estos enlaces pueden romperse por hidrólisis. Cuando se unen dos, tres o muchas unidades de monosacáridos, forman disacáridos, trisacáridos, oligosacáridos o polisacáridos. Las enzimas que rompen estos enlaces se llaman "glucosidasas".
Un disacárido muy conocido es la sacarosa (el azúcar de mesa). La hidrólisis de la sacarosa produce glucosa y fructosa. La invertasa es una enzima que se usa en la industria para hidrolizar la sacarosa y obtener un tipo de azúcar llamado azúcar invertido. Otra enzima importante es la lactasa, necesaria para digerir la lactosa de la leche. Muchas personas adultas no producen suficiente lactasa y por eso no pueden digerir la leche.
La hidrólisis de los polisacáridos para obtener azúcares más pequeños se conoce como sacarificación. Por ejemplo, la malta (hecha de cebada) contiene una enzima llamada β-amilasa que rompe el almidón en maltosa (un disacárido). La levadura puede usar esta maltosa para producir cerveza. Otras enzimas amilasas pueden convertir el almidón en glucosa. La celulosa, que es un componente principal de las plantas, es hidrolizada primero en celobiosa y luego en glucosa por enzimas llamadas celulasas. Algunos animales, como las vacas, pueden digerir la celulosa gracias a bacterias especiales en su sistema digestivo que producen estas celulasas.
Ejemplos de hidrólisis de compuestos orgánicos
La hidrólisis ocurre en muchos compuestos orgánicos. Aquí tienes algunos ejemplos:
- Hidrólisis de cloruros de ácidos carboxílicos para formar ácidos carboxílicos.
- Hidrólisis de carburo de calcio para producir acetileno.
- Hidrólisis de amidas de ácidos carboxílicos para formar ácidos carboxílicos.
- Hidrólisis de grasas vegetales o animales para obtener glicerol y ácidos grasos.
- Hidrólisis de éster de ácido carboxílico para formar ácido carboxílico y alcohol.
- Hidrólisis de acetales y cetales para formar aldehídos o cetonas y alcoholes.
- Hidrólisis de nitrilos para formar amidas de ácidos carboxílicos.
- Hidrólisis de iminas e hidrazonas para formar aldehídos o cetonas.
La mayoría de estas reacciones de hidrólisis ocurren mejor y más rápido si se realizan en un ambiente ácido o básico, en lugar de un ambiente neutro. Un ejemplo es la hidrólisis ácida de los ésteres, que es la reacción inversa a la esterificación, y la saponificación, que se realiza en un ambiente básico.
Galería de imágenes
Véase también
 En inglés: Hydrolysis Facts for Kids
En inglés: Hydrolysis Facts for Kids
- Hidrólisis enzimática
- Tampón químico


