Lisozima para niños
Datos para niños Lisozima,LYSC |
||||||
|---|---|---|---|---|---|---|
 Lisozima de Gallo
|
||||||
| Estructuras disponibles | ||||||
| PDB |
Buscar ortólogos: PDBe, RCSB Estructuras enzimáticas
RCSB PDB, PDBe, PDBsum
|
|||||
| Identificadores | ||||||
| Nomenclatura |
Otros nombres
Muramidase,
Globulin G |
|||||
| Símbolo | LYSC (HGNC: 6740) | |||||
| Identificadores externos |
Bases de datos de enzimas
IntEnz: entrada en IntEnz
BRENDA: entrada en BRENDA ExPASy: NiceZime view KEGG: entrada en KEEG PRIAM: perfil PRIAM ExplorEnz: entrada en ExplorEnz MetaCyc: vía metabólica |
|||||
| Número EC | 3.2.1.17 | |||||
| Locus | Cr. 12 q15 | |||||
|
||||||
| Estructura/Función proteica | ||||||
| Tamaño | 148 (aminoácidos) | |||||
| Peso molecular | 16.537 (Da) | |||||
| Estructura | Globular | |||||
| Tipo de proteína | Enzima | |||||
| Dominio proteico | Lisozima C | |||||
| Motivos | Hélices alfa, Láminas beta. |
|||||
| Ortólogos | ||||||
| Especies |
|
|||||
| Entrez |
|
|||||
| UniProt |
|
|||||
| RefSeq (ARNm) |
|
|||||
| PubMed (Búsqueda) |
|
|||||
| PMC (Búsqueda) |
|
|||||
La lisozima, también conocida como muramidasa, es una proteína especial que ayuda a proteger nuestro cuerpo. Su principal trabajo es dañar las paredes de las bacterias, actuando como una barrera natural contra las infecciones. La encontramos en muchas de nuestras secreciones, como la saliva, las lágrimas y el moco.
Contenido
¿Qué es la Lisozima y cómo nos protege?
La lisozima es una proteína pequeña, formada por unos 148 aminoácidos. Es como un "soldado" universal que defiende a los animales de las infecciones.
Tipos de Lisozima
Existen tres tipos principales de lisozima, que se diferencian por su estructura:
- Lisozima de ganso (tipo g).
- Lisozima convencional o de gallina (tipo c).
- Lisozima de invertebrados (tipo i).
¿Dónde se encuentra la Lisozima?
Esta proteína es muy común en nuestro cuerpo. La puedes encontrar en:
- La saliva.
- Las lágrimas.
- El moco.
- La leche humana y de yegua, donde es un factor importante de defensa.
- Ciertas células de nuestro sistema inmunitario llamadas neutrófilos.
La lisozima ataca la pared celular de las bacterias. Lo hace rompiendo unos enlaces específicos en una parte de la pared llamada peptidoglicano. Esto debilita a las bacterias y las ayuda a eliminarse.
¿Qué pasa si falta Lisozima?
Si una persona tiene muy poca lisozima debido a cambios en el gen LYZ (que se encuentra en el cromosoma 12), puede tener problemas en sus huesos. También podría ser más propensa a sufrir infecciones.
Usos de la Lisozima en la industria
La lisozima que se obtiene de la clara de huevo se usa en la industria. Por ejemplo:
- Ayuda a controlar las bacterias en los vinos.
- Se usa en la fabricación de quesos para protegerlos de ciertas bacterias.
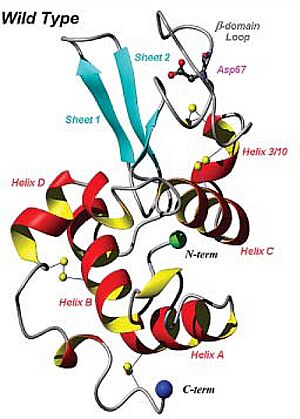
¿Cómo es la Lisozima por dentro?
La lisozima tiene una forma tridimensional específica que le permite cumplir su función.
Estructura Primaria
La lisozima humana está hecha de 130 aminoácidos. Estos aminoácidos se unen en una secuencia específica, como si fueran las cuentas de un collar.
Estructura Secundaria
Esta proteína tiene partes que se pliegan de formas repetitivas. Las más comunes son:
- Hélices alfa (α helix): Son como espirales.
- Láminas beta (β sheet): Son como láminas planas y plegadas.
| Referencia | Ubicación en la proteína |
|---|---|
| Hélice alfa (α). A | Aminoácidos 5-14 |
| Hélice alfa. B | Aminoácidos 20-22 |
| Hélice alfa. C | Aminoácidos 25-36 |
| Lámina beta (β) 1. | Aminoácidos 43-46 |
| Lámina beta 2. | Aminoácidos 51-54 |
| Hélice alfa. D | Aminoácidos 81-85 |
| Hélice alfa. E | Aminoácidos 90-101 |
| Hélice alfa. F | Aminoácidos 105-108 |
| Hélice alfa. G | Aminoácidos 110-115 |
| Hélice alfa. H | Aminoácidos 122-124 |
Estructura Terciaria
La lisozima se pliega en una forma compacta y redonda, con una ranura en su superficie. Esta ranura es importante para que pueda unirse a las bacterias. La lisozima humana tiene varias hélices alfa y láminas beta.
¿Cómo funciona la Lisozima en el cuerpo?
La lisozima humana es producida por diferentes glándulas exocrinas y se libera en los líquidos de nuestro cuerpo. También la producen algunos tejidos y células de defensa.
Muchas bacterias que la lisozima afecta no son dañinas. En algunos casos, la lisozima es la razón principal por la que estos organismos no causan enfermedades. La lisozima cambia la pared celular de las bacterias dañinas, transformándolas.
La lisozima actúa de dos maneras:
- Como una opsonina: Ayuda a que otras células de defensa reconozcan y eliminen a las bacterias.
- Como una enzima: Rompe directamente las paredes de las bacterias.
La lisozima humana es más efectiva que la lisozima de pollo para combatir bacterias.
Además de su función contra las bacterias, se ha visto que la lisozima puede ayudar a detener el crecimiento de ciertas células problemáticas en el cuerpo.
¿Cuál es el papel clave de la Lisozima?
Las lisozimas son parte de los péptidos antimicrobianos. Estos péptidos se unen a la superficie de las bacterias, lo que ayuda a que las células de nuestro sistema inmunitario lleguen y actúen.
Como enzima, la lisozima ataca los peptidoglicanos, que son componentes clave de la pared celular de las bacterias, especialmente las gram positivas. Rompe un tipo específico de enlace en estas moléculas.
Para hacer esto, la lisozima se une a la molécula de peptidoglicano en un lugar especial llamado sitio activo. Esto hace que la molécula de la bacteria se estire, facilitando que el enlace se rompa. Dos aminoácidos, el ácido glutámico 35 y el ácido aspártico 52, son esenciales para que esta enzima funcione correctamente.
Algunas bacterias han desarrollado formas de resistir la acción de la lisozima, modificando la cadena de su peptidoglicano.
¿Qué relación tiene la Lisozima con algunas enfermedades?
Algunas enfermedades raras, llamadas amiloidosis, pueden ser causadas por cambios en el gen de la lisozima. Esto provoca que esta enzima se acumule en diferentes tejidos del cuerpo.
Historia del descubrimiento de la Lisozima
La lisozima fue descubierta en 1922 por Alexander Fleming. Él también descubrió la penicilina, otro importante agente antimicrobiano.
La estructura de la lisozima fue descrita en detalle por David Chilton Phillips en 1965. Su trabajo ayudó a entender cómo las enzimas aceleran las reacciones químicas.
Otros científicos, como Howard Florey y Ernst B. Chain, también investigaron las lisozimas. Aunque no hicieron grandes avances en este campo, junto con Fleming, desarrollaron la penicilina.
Véase también
 En inglés: Lysozyme Facts for Kids
En inglés: Lysozyme Facts for Kids