ADN polimerasa para niños
Datos para niños ADN polimerasa ADN-dirigida |
||||||
|---|---|---|---|---|---|---|
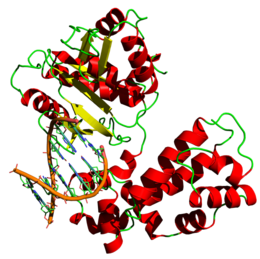 Estructura tridimensional de los motivos hélice-giro-hélice de unión al ADN de una ADN polimerasa beta humana (basada en el archivo PDB 7ICG )
|
||||||
| Estructuras disponibles | ||||||
| PDB |
Estructuras enzimáticas
RCSB PDB, PDBe, PDBsum
|
|||||
| Identificadores | ||||||
| Identificadores externos |
Bases de datos de enzimas
IntEnz: entrada en IntEnz
BRENDA: entrada en BRENDA ExPASy: NiceZime view KEGG: entrada en KEEG PRIAM: perfil PRIAM ExplorEnz: entrada en ExplorEnz MetaCyc: vía metabólica |
|||||
| Número EC | 2.7.7.7 | |||||
| Número CAS | 9012-90-2 | |||||
|
||||||
| Ortólogos | ||||||
| Especies |
|
|||||
| PubMed (Búsqueda) |
|
|||||
| PMC (Búsqueda) |
|
|||||
Las ADN polimerasas son enzimas muy importantes que se encuentran en las células y en los virus. Su trabajo principal es ayudar en la replicación del ADN, que es el proceso por el cual el ADN se copia a sí mismo.
Estas enzimas construyen una nueva cadena de ADN uniendo piezas llamadas desoxirribonucleótidos. Estas piezas se unen a las que ya existen en la cadena original de ADN, siguiendo un patrón específico. Los desoxirribonucleótidos que se usan tienen tres fosfatos y se llaman dATP, dTTP, dCTP o dGTP, dependiendo de su base.
La ADN polimerasa añade estas piezas una por una. Cuando una nueva pieza se une, se libera una molécula llamada pirofosfato. Esto permite que la cadena de ADN crezca.
Aunque la ADN polimerasa tiene un solo lugar para unir las cuatro piezas diferentes, es muy precisa. Si una pieza no encaja bien, la enzima lo detecta y ralentiza el proceso, asegurándose de que solo se añadan las piezas correctas.
Las ADN polimerasas son muy rápidas. Pueden añadir hasta 1000 piezas por segundo. Su velocidad depende de cuánto tiempo permanecen unidas al ADN que están copiando.
La nueva cadena de ADN siempre crece en una dirección específica (de 5' a 3'). Para empezar a copiar, la ADN polimerasa necesita una pequeña pieza inicial llamada cebador. Este cebador es como un punto de partida y es creado por otra enzima, la ARN primasa.
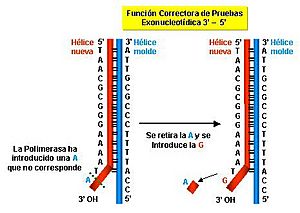
Además de copiar el ADN, las ADN polimerasas también tienen una función muy importante: corregir errores. Si se equivocan al añadir una pieza, pueden retroceder y quitarla. Esto es vital para evitar cambios en el ADN que podrían ser perjudiciales.
Contenido
¿Cómo funcionan las ADN polimerasas?
Las ADN polimerasas solo pueden añadir nuevas piezas al final de una cadena de ADN que ya existe. No pueden empezar una cadena desde cero. Por eso, siempre necesitan un cebador (una pequeña cadena inicial) al que puedan añadir más piezas. Estos cebadores pueden ser de ARN o ADN.
Para que la ADN polimerasa pueda trabajar, otra enzima llamada helicasa ayuda a desenrollar el ADN. El ADN tiene una forma de doble hélice, y la helicasa la abre como una cremallera, creando una "horquilla de replicación". Esto permite que cada una de las dos cadenas se copie por separado.
Corrección de errores
Una característica clave de algunas ADN polimerasas es su capacidad para corregir errores. Si la enzima coloca una pieza incorrecta, puede retroceder y quitarla. Esta función se llama "corrección de pruebas". Es como tener un borrador incorporado que asegura que la copia del ADN sea lo más exacta posible.
Las ADN polimerasas tienen una estructura muy similar en diferentes seres vivos. Esto significa que su forma y cómo funcionan son muy importantes para la célula, y por eso se han mantenido casi iguales a lo largo de la evolución.
Estructura de la ADN polimerasa
La forma de la ADN polimerasa se parece a una mano derecha. Tiene tres partes principales: el "pulgar", el "dedo" y la "palma".
- La palma es donde ocurre la magia, ayudando a unir las piezas de ADN.
- Los dedos se encargan de reconocer y unir las nuevas piezas con la cadena original.
- El pulgar ayuda a mover el ADN y a mantenerlo en la posición correcta.
Velocidad y procesividad
La gran velocidad de la ADN polimerasa se debe a su "procesividad". Esto se refiere a cuántas piezas puede añadir la enzima cada vez que se une a la cadena de ADN. Una vez que se une, una ADN polimerasa procesiva puede añadir muchas piezas por segundo, lo que acelera mucho la copia del ADN.
Para ser aún más procesivas, las ADN polimerasas trabajan con otras proteínas llamadas "pinzas deslizantes". Estas pinzas son como anillos que rodean el ADN y mantienen a la polimerasa unida a él. Esto evita que la enzima se suelte y tenga que volver a unirse, lo que la hace mucho más eficiente.
Usos de las ADN polimerasas
La capacidad de las ADN polimerasas para copiar el ADN se utiliza mucho en biología molecular. Un ejemplo famoso es la reacción en cadena de la polimerasa (PCR).
Reacción en cadena de la polimerasa (PCR)
La PCR es una técnica que usa ADN polimerasas especiales (que aguantan altas temperaturas, como la polimerasa Taq) para hacer muchísimas copias de un fragmento específico de ADN. Esto es muy útil para la investigación, por ejemplo, para estudiar genes o identificar organismos.
Tipos de ADN polimerasas
Las ADN polimerasas se clasifican en diferentes familias según su estructura y las piezas que las forman. Hay seis familias principales: A, B, D, X, Y y RT.
ADN polimerasas en bacterias y arqueas
En los procariotas (organismos como las bacterias y las arqueas), existen varias ADN polimerasas, como la Pol I, II, III, IV, V, B, D y la RT. Cada una tiene funciones específicas en la copia y reparación del ADN.
- Pol I: Ayuda a reparar el ADN y a procesar pequeños fragmentos de ADN que se forman durante la copia.
- Pol II: Participa en la reparación del ADN y puede actuar como respaldo de la Pol III.
- Pol III: Es la enzima principal que copia el ADN en las bacterias. Es muy rápida y precisa.
- Pol IV y Pol V: Estas polimerasas son más propensas a errores, pero son importantes para copiar ADN dañado, permitiendo que la célula siga funcionando.
Transcriptasa inversa (RT)
Esta es una ADN polimerasa especial que puede crear ADN a partir de una plantilla de ARN (en lugar de ADN). Es muy importante en los virus retrotranscritos, como el VIH, y también se usa mucho en investigación para estudiar el ARN.
ADN polimerasas en eucariotas
En los eucariotas (organismos con células más complejas, como plantas, animales y hongos), hay muchos tipos de ADN polimerasas.
- Polimerasas α, δ y ε (alfa, delta y épsilon): Son las principales enzimas que copian el ADN en el núcleo de la célula. La Pol α inicia la copia, y luego la Pol δ y la Pol ε continúan el proceso, siendo muy procesivas.
- Polimerasas β, λ, σ, μ (beta, lambda, sigma, mu) y TdT: Estas polimerasas están involucradas principalmente en la reparación del ADN, ayudando a corregir daños o a unir extremos rotos de la cadena.
- Polimerasas η, ι y κ (eta, iota y kappa): Son importantes para copiar ADN que tiene algún tipo de daño, permitiendo que la replicación continúe a pesar de los obstáculos.
- Polimerasas γ, θ y ν (gamma, theta y nu): La Pol γ es la principal polimerasa en las mitocondrias (las "centrales de energía" de la célula), donde copia el ADN mitocondrial. Las otras también tienen roles en la reparación.
Telomerasa
La telomerasa es una enzima muy especial que se encarga de copiar los extremos de los cromosomas, llamados telómeros. Los telómeros son como las tapas protectoras de los cromosomas. La telomerasa es única porque no necesita una plantilla de ADN para empezar a copiar, sino que usa una plantilla de ARN que lleva consigo. Se cree que el acortamiento de los telómeros con el tiempo está relacionado con el envejecimiento.
ADN polimerasas en virus
Los virus de ADN tienen sus propias ADN polimerasas, que son diferentes a las de las células. Los virus retrotranscritos, como el VIH, tienen transcriptasas inversas, que son esenciales para su ciclo de vida.
Un ejemplo es la ADN polimerasa del fago Φ29, que es muy usada en laboratorios para copiar ADN de forma muy eficiente.
Galería de imágenes
-
Holoenzima ADN Pol III de E. coli.
Véase también
 En inglés: DNA polymerase Facts for Kids
En inglés: DNA polymerase Facts for Kids