Tortuga boba para niños
Datos para niños
Tortuga boba |
||
|---|---|---|
| Rango temporal: 40 Ma - 0 Ma Cretácico - Reciente | ||
 Una tortuga boba en reposo.
|
||
| Estado de conservación | ||
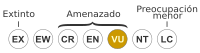 Vulnerable (UICN 3.1) |
||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Reptilia | |
| Orden: | Testudines | |
| Superfamilia: | Chelonioidea | |
| Familia: | Cheloniidae | |
| Género: | Caretta Rafinesque, 1814 |
|
| Especie: | Caretta caretta (Linnaeus, 1758) |
|
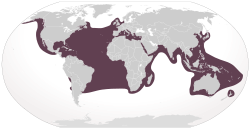
| Distribución | ||
|
Sinonimia de especie
Testudo Caretta
Linnaeus, 1758 Testudo Cephalo Schneider, 1783 Testudo nasicornis Lacépède, 1788 Testudo Caouana Lacépède, 1788 Chelone caretta Brongniart, 1805 Chelonia Caouanna Schweigger, 1812 Caretta nasuta Rafinesque, 1814 Chelonia cavanna Oken, 1816 Caretta atra Merrem, 1820 Caretta Cephalo Merrem, 1820 Caretta nasicornis Merrem, 1820 Chelonia caretta Bory de Saint-Vincent, 1828 Testudo Corianna Gray, 1831 Chelonia pelasgorum Valenciennes en Bory de Saint-Vincent, 1833 Chelonia cephalo Gray, 1829 Chelonia (Caretta) cephalo Lesson en Bélanger, 1834 Chelonia caouanna Duméril & Bibron, 1835 Chelonia (Thalassochelys) Caouana Fitzinger, 1836 Chelonia (Thalassochelys) atra Fitzinger, 1836 Thalassochelys caretta Bonaparte, 1838 Chelonia (Caouanna) cephalo Cocteau en Cocteau & Bibron en Ramon de la Sagra, 1838 Halichelys atra Fitzinger, 1843 Caounana Caretta Gray, 1844 Caouana elongata Gray, 1844 Thalassochelys Caouana Agassiz, 1857 Thalassochelys corticata Girard, 1858 Chelonia corticata Strauch, 1862 Thalassochelys elongata Strauch, 1862 Thalassochelys caouana Nardo, 1864 Eremonia elongata Gray, 1873 Caretta caretta Stejneger, 1873 Thalassochelys cephalo Barbour & Cole, 1906 Caretta caretta caretta Mertens & Muller, 1928 Caretta gigas Deraniyagala, 1933 Caretta caretta gigas Deraniyagala, 1939 Caretta caretta tarapacana Caldwell, 1962 Chelonia cahuano Tamayo, 1962 Caretta careta Tamayo, 1962 Sinonimia de género
Caretta
Rafinesque, 1814 Caretta (Thalassochelys) Fitzinger, 1835 Thalassochelys Bonaparte, 1838 Caouana Cocteau in Ramon de la Sagra, 1838 Halichelys Fitzinger, 1843 Eremonia Gray, 1873 ?Pliochelys Portis, 1890 ?Proganosaurus Portis, 1890 |
||
La tortuga boba (Caretta caretta) es una especie de tortuga marina que vive en los océanos Atlántico, Pacífico e Índico, y también en el Mediterráneo. Es la única especie de su género, Caretta, y pertenece a la familia Cheloniidae, que incluye a la mayoría de las tortugas marinas.
Contenido
¿Cómo se clasifica la tortuga boba?
Carlos Linneo le dio su primer nombre científico, Testudo caretta, en 1758. Más tarde, en 1902, Leonhard Stejneger sugirió el nombre Caretta caretta, que es el que usamos hoy. El nombre común "boba" o "cabezona" se refiere a su cabeza, que es bastante grande en comparación con su cuerpo.
La tortuga boba es parte de la familia Cheloniidae. Esta familia agrupa a todas las tortugas marinas, excepto la tortuga laúd. Los científicos debaten si la tortuga boba tiene subespecies, pero la mayoría cree que es una sola especie con algunas variaciones. Se ha descubierto que la tortuga boba puede cruzarse con otras tortugas marinas, como la tortuga bastarda, la tortuga carey y la tortuga verde.
¿Dónde vive la tortuga boba?
La tortuga boba pasa casi toda su vida en el mar, en aguas costeras que no son muy profundas. Solo las hembras salen a la costa por poco tiempo para hacer sus nidos y poner huevos. Las crías viven entre algas flotantes llamadas Sargassum. Las tortugas jóvenes y adultas prefieren vivir cerca de la costa y en estuarios (donde un río se encuentra con el mar).
En el Atlántico noroccidental, las tortugas jóvenes se encuentran más en estuarios poco profundos. Las adultas, que no están anidando, tienen más acceso al mar abierto. Fuera de la época de anidación, viven en aguas con temperaturas entre 13.3 °C y 28.0 °C. Para las hembras que van a anidar, la temperatura ideal es entre 27 °C y 28 °C.
Las algas Sargassum son un hogar para muchas especies, algunas de las cuales son alimento para las tortugas jóvenes. Entre sus presas se encuentran pequeños cangrejos, huevos de peces y colonias de hidrozoos.
¿Dónde se encuentra la tortuga boba en el mundo?
La tortuga boba se encuentra en muchos lugares del mundo, más que cualquier otra tortuga marina. Vive en el Océano Atlántico, Océano Índico, Océano Pacífico y el mar Mediterráneo.
En el Atlántico, la mayor cantidad de tortugas bobas se encuentra en la costa sureste de América del Norte y en el golfo de México. Florida es un lugar muy importante para anidar, con más de 67.000 nidos al año. Las islas de Cabo Verde son el único lugar importante de anidación en el este del Atlántico.
En el Índico, buscan alimento cerca de las costas de África y la península arábiga. Omán es el segundo lugar más grande del mundo para el anidamiento de tortugas bobas, con unos 15.000 nidos. La costa de Australia Occidental también es importante.
En el Pacífico, viven en zonas templadas y tropicales. Las principales áreas de anidación están en el este de Australia y en Japón. La Gran Barrera de Coral es una zona clave. La isla de Yakushima en Japón es el sitio más importante, donde anida el 40% de las tortugas bobas de esa zona.
El mar Mediterráneo es un lugar donde las tortugas jóvenes crecen y los adultos se alimentan en primavera y verano. Casi la mitad de las tortugas jóvenes del Mediterráneo vienen del Atlántico. Grecia es la principal zona de anidación en el Mediterráneo, con más de 3.000 nidos al año.
¿Cómo evolucionó la tortuga boba?
Las tortugas marinas de hoy probablemente tienen un ancestro común que vivió hace unos 40 millones de años, en el período Cretácico. La tortuga boba pertenece a la antigua familia Cheloniidae. De las seis especies de Cheloniidae que existen, la tortuga boba está más relacionada con la tortuga bastarda, la tortuga golfina y la tortuga carey.
Hace unos tres millones de años, durante el Plioceno, América Central se levantó del mar. Esto separó las corrientes marinas entre el Atlántico y el Indo-Pacífico. Este cambio llevó a un ciclo de glaciaciones en la Tierra. Las aguas frías en el cabo de Buena Esperanza y el cabo de Hornos crearon barreras que impidieron que las tortugas migraran. Esto hizo que las poblaciones del Atlántico y del Pacífico quedaran separadas.
Durante la última Edad de Hielo, las playas del sureste de América del Norte eran muy frías para los huevos de tortuga. Cuando la Tierra se calentó, las tortugas bobas se extendieron hacia el norte. Por eso, las tortugas que anidan en Carolina del Norte y el norte de Florida son genéticamente diferentes de las del sur de Florida.
Las poblaciones de tortugas bobas tienen diferencias genéticas. Por ejemplo, las tortugas bobas del Mediterráneo son más pequeñas que las del Atlántico.
¿Cómo es el cuerpo de la tortuga boba?
La tortuga boba es la tortuga con caparazón duro más grande del mundo. Los adultos suelen pesar entre 80 y 200 kg y medir de 70 a 95 cm de largo. El caparazón y la cabeza pueden ser de color amarillo-naranja a marrón-rojizo. La parte de abajo (el plastrón) es de color amarillo pálido.
El caparazón es como una armadura, pero las tortugas bobas no pueden esconder su cabeza o patas dentro de él. El caparazón tiene dos partes: el carapacho (arriba) y el plastrón (abajo). Está formado por grandes placas llamadas escudos.
Los machos adultos tienen colas y garras más largas que las hembras. El plastrón de los machos es más corto. Los machos también suelen tener cabezas más grandes. No se puede saber el sexo de las tortugas jóvenes solo mirándolas por fuera.
Las tortugas bobas tienen glándulas lagrimales detrás de los ojos. Estas glándulas les ayudan a eliminar el exceso de sal que obtienen al beber agua de mar. Cuando están en tierra, parece que están llorando, pero solo están eliminando sal.
¿Cómo se comportan las tortugas bobas?
Las tortugas bobas son más activas durante el día. En cautiverio, pasan el tiempo nadando y descansando en el fondo. Por la noche, duermen con los ojos cerrados y reaccionan lentamente. Pasan hasta el 85% del día bajo el agua. Los machos bucean más que las hembras. Pueden estar sumergidas de 15 a 30 minutos, y a veces hasta cuatro horas.
La temperatura del agua afecta a las tortugas. Si el agua está entre 13 y 15 °C, se vuelven lentas. Si baja a 10 °C, pueden quedar aturdidas por el frío. Las tortugas jóvenes son más resistentes al frío. Para evitar el frío, las tortugas migran. Las temperaturas más altas aceleran su metabolismo y ritmo cardíaco.
Las tortugas bobas pueden ser agresivas entre sí, especialmente las hembras, cuando compiten por zonas de alimentación. La agresión puede ir desde una postura de amenaza hasta una pelea. Una cola levantada muestra que quieren pelear, mientras que una cola enrollada indica que se rinden.
¿Qué animales cazan a la tortuga boba?

La tortuga boba tiene muchos depredadores, sobre todo cuando son huevos o crías. Los huevos y las crías son cazados por gusanos, escarabajos, moscas, hormigas, cangrejos, serpientes, gaviotas, zorros, mapaches, ratas, perros y gatos, entre otros. Cuando las crías van del nido al mar, son atacadas por cangrejos, sapos, lagartos y aves.
En el océano, los depredadores de las crías incluyen peces y cangrejos. Los adultos son más grandes y rara vez son atacados, pero pueden ser presa de tiburónes y orcas. Hasta el 40% de las hembras que anidan tienen heridas, probablemente por ataques de tiburones.
En Australia, la llegada del zorro rojo en el siglo XIX causó una gran disminución de las tortugas bobas. En los años 70, los zorros destruyeron hasta el 95% de los nidos en algunas zonas. Gracias a campañas para eliminar zorros, el problema ha mejorado.
En el sureste de Estados Unidos, el mapache es el depredador más dañino para los nidos. En algunas playas de Florida, casi el 100% de los nidos fueron destruidos por mapaches. Para proteger los nidos, se cubren con mallas metálicas. Sin embargo, se investiga si el metal afecta la capacidad de las tortugas para navegar usando el campo magnético de la Tierra.
¿Qué enfermedades y parásitos afectan a la tortuga boba?
Bacterias como Pseudomonas y Salmonella pueden afectar a las crías y los huevos. Hongos como Penicillium pueden infectar los nidos.
Una enfermedad llamada fibropapilomatosis, causada por un virus, puede provocar tumores internos y externos. Estos tumores pueden afectar el comportamiento de la tortuga y causar ceguera. También pueden tener parásitos como trematodos y nematodos, que viven en sus tejidos y órganos, causando problemas de salud.
Más de 100 tipos de animales y 37 tipos de algas pueden vivir en el caparazón de la tortuga boba. Estos organismos aumentan la fricción en el agua y no se sabe que beneficien a la tortuga, aunque podrían ayudarla a camuflarse.
¿Qué come la tortuga boba?

La tortuga boba es omnívora, lo que significa que come de todo. Tiene la dieta más variada de todas las tortugas marinas. Sus alimentos principales son animales pequeños que viven en el fondo del mar, como caracoles, almejas, cangrejos, esponjas, corales, gusanos, anémonas de mar, pulpos, erizos de mar y estrellas de mar. También come peces, huevos de peces, tortugas recién nacidas (incluso de su propia especie), insectos, algas y plantas.
Cuando migra por el mar abierto, come medusas, moluscos flotantes, huevos flotantes, calamares y peces voladores.
Sus mandíbulas son grandes y fuertes, perfectas para romper sus presas. También tienen puntos en sus aletas delanteras que les ayudan a manipular la comida y arrancar pedazos grandes.
¿Cómo es el ciclo de vida de la tortuga boba?
Los primeros años de vida
Las crías de tortuga boba son de color marrón claro a casi negro, sin los tonos amarillos y rojos de los adultos. Al nacer, miden unos 4.6 cm y pesan unos 20 gramos. Los huevos se ponen en la playa, por encima de la línea de marea alta, para que las crías puedan llegar al mar fácilmente.
El sexo de las crías depende de la temperatura del nido. Si la temperatura es de 32 °C, nacen hembras. Si es de 28 °C, nacen machos. A 30 °C, nacen machos y hembras por igual. Las crías del centro del nido suelen ser más grandes y activas.
La incubación dura unos 80 días. Después, las crías salen de la arena, generalmente de noche, para evitar depredadores y el calor del día. Se dirigen al océano, guiándose por el brillo del horizonte que crean las estrellas y la luna en el agua.
Al llegar al mar, nadan unas 20 horas para alejarse de la costa. Las tortugas usan un compuesto de hierro en su cerebro para sentir el campo magnético de la Tierra y navegar. Muchas crías se esconden en las algas Sargassum hasta que crecen.
¿Cuándo maduran las tortugas bobas?
Cuando el agua del océano se enfría, las tortugas bobas migran a lugares más cálidos. También pueden hibernar un poco; en los meses fríos, se sumergen hasta siete horas, saliendo solo siete minutos para respirar. Durante sus migraciones, las tortugas jóvenes usan señales magnéticas y visuales para navegar. Nadan a una velocidad de aproximadamente 1.6 km por hora.
Las hembras en el sureste de Estados Unidos y Australia se reproducen por primera vez entre los 28 y 33 años. En Sudáfrica, esto ocurre entre los 17 y 30 años. Su esperanza de vida máxima en la naturaleza es de unos 47 a 67 años.
¿Cómo se reproducen las tortugas bobas?
Las hembras se reproducen por primera vez entre los 17 y 33 años. El período de apareamiento dura hasta seis semanas. Los machos cortejan a las hembras con movimientos de cabeza y aletas. Las hembras pueden liberar sustancias químicas para indicar que están listas para reproducirse.
Si hay otros machos, la hembra puede dejar que peleen. El macho ganador se aparea con la hembra. Durante el apareamiento, las garras del macho pueden dañar el caparazón de la hembra. Otros machos pueden morder al macho que se aparea, causándole heridas.
Las hembras ponen un promedio de 3.9 nidos de huevos por temporada. Luego, descansan de la reproducción por dos o tres años. A diferencia de otras tortugas marinas, el apareamiento no suele ocurrir cerca de la playa de anidación, sino en las rutas de migración. Se cree que el apareamiento hace que la hembra ovule y los huevos sean fertilizados.
En el Mediterráneo, el apareamiento es de finales de marzo a principios de junio. La temporada de anidación es en junio y julio.
Todas las tortugas marinas tienen un comportamiento de anidación similar. Durante la temporada, la hembra regresa a la playa donde nació para poner huevos cada 12 a 17 días. Sale del agua, sube a la playa y cava un hoyo para su cuerpo. Con sus patas traseras, excava un agujero más profundo para los huevos. Luego, cubre los huevos y el hoyo con arena y regresa al mar. Este proceso dura de una a dos horas. La tortuga boba pone un promedio de 70 huevos por nido.
¿Cómo se protege a la tortuga boba?
Muchas actividades humanas afectan negativamente a las tortugas bobas. Su largo tiempo para madurar y la alta mortalidad de huevos y crías por depredadores y fenómenos naturales empeoran el problema.
¿Cuáles son las amenazas para la tortuga boba?

Las tortugas bobas fueron cazadas por su carne y huevos. Aunque la caza ha disminuido por leyes internacionales, todavía ocurre en algunos lugares. Comer carne o huevos de tortuga puede causar enfermedades graves por bacterias y altos niveles de metales tóxicos.
Los equipos de pesca son una gran amenaza. Las tortugas a menudo se enredan en palangres (líneas largas con muchos anzuelos) o redes de enmalle. Esto puede causarles heridas graves o ahogamiento. Los dispositivos excluidores de tortugas (DET) en las redes de pesca pueden ayudar a que las tortugas escapen.
Cada año, miles de toneladas de plástico llegan al océano. Las tortugas confunden el plástico con medusas, que son parte de su alimento. Ingerir plástico les causa problemas de salud, como obstrucción intestinal, falta de nutrientes, asfixia o inanición. Además, los plásticos liberan sustancias tóxicas que pueden afectar sus tejidos y huevos.
La iluminación artificial en las playas es un problema. Desanima a las hembras a anidar y confunde a las crías. Las crías se guían por la luz natural de la luna y las estrellas para ir al mar. La luz artificial las desorienta, haciéndolas ir tierra adentro, donde mueren por deshidratación o depredadores.
La destrucción de hábitat por los humanos también es una amenaza. Las construcciones en las playas reducen los lugares adecuados para anidar, obligando a las tortugas a poner huevos más cerca del agua. La construcción de puertos también daña sus hábitats. El tráfico de barcos puede herir o matar a las tortugas.
Los cambios en la temperatura del clima pueden afectar el sexo de las crías, ya que la temperatura del nido lo determina. Temperaturas más cálidas pueden hacer que nazcan más hembras. Esto preocupa a los científicos por el cambio climático y el riesgo de que la población de tortugas bobas disminuya.
¿Qué se hace para proteger a la tortuga boba?
Como la tortuga boba vive en muchos lugares, su protección necesita la cooperación de varios países. La Unión Internacional para la Conservación de la Naturaleza (UICN) la clasifica como especie vulnerable. El comercio internacional de esta especie está prohibido por la Convención sobre el Comercio Internacional de Especies Amenazadas.
En Estados Unidos, se considera una especie amenazada. En Australia, es una especie en peligro de extinción. También está protegida por acuerdos internacionales como la Convención sobre la Conservación de Especies Migratorias de Animales Silvestres.
Organizaciones en Japón y Grecia trabajan para proteger a las tortugas bobas. En la isla de Zacinto, Grecia, no se permite que los aviones despeguen o aterricen de noche para proteger a las tortugas que anidan.
Las organizaciones de conservación trabajan con la industria pesquera para usar dispositivos de exclusión de tortugas (DET). Estos dispositivos son obligatorios en los barcos camaroneros para evitar que las tortugas queden atrapadas.
Durante la temporada de anidación, voluntarios y científicos vigilan las costas para encontrar nidos. A veces, los nidos se reubican para proteger los huevos de mareas altas o depredadores. Después de que los huevos eclosionan, se revisan los nidos para contar los huevos y liberar a las crías que aún están vivas. El camino de las crías del nido al mar es importante para que desarrollen fuerza para nadar.
En Estados Unidos, la tortuga boba es el reptil oficial de los estados de Carolina del Sur y Florida.
Galería de imágenes
Véase también
 En inglés: Loggerhead sea turtle Facts for Kids
En inglés: Loggerhead sea turtle Facts for Kids
- Chelonioidea, la superfamilia de la tortuga boba.
- Tortuga verde.
- Tortuga carey.
- Tortuga laúd.
- Tortuga olivácea.
- Tortuga bastarda.
- Tortuga plana.