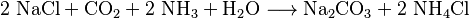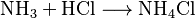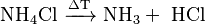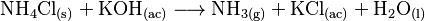Cloruro de amonio para niños
Datos para niños
Cloruro de amonio |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Cloruro de amonio | ||
| General | ||
| Otros nombres | Cloruro amónico clorhidrato amónico Sal amoniacal |
|
| Fórmula estructural | <chem>[NH4]-Cl</chem> | |
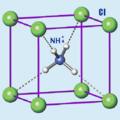
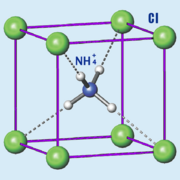
| Fórmula molecular | <chem>NH4Cl</chem> | |
| Identificadores | ||
| Número CAS | 12125-02-9 | |
| ChEBI | CHEBI:31206 | |
| ChEMBL | CHEMBL1200939 | |
| ChemSpider | 23807 | |
| PubChem | 25517 | |
| UNII | 01Q9PC255D | |
| KEGG | D01139 | |
|
[Cl-].[H][N+]([H])([H])[H]
|
||
|
InChI
InChI=InChI=1S/ClH.H3N/h1H;1H3
Key: NLXLAEXVIDQMFP-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | blanco | |
| Densidad | 1527 kg/m³; 1,527 g/cm³ | |
| Masa molar | 53,49 g/mol | |
| Punto de fusión | 338 °C (611 K) | |
| Índice de refracción (nD) | 1,642 | |
| Propiedades químicas | ||
| Acidez | 9,24 pKa | |
| Solubilidad en agua | 244 g/L (−15 °C) 294 g/L (0 °C) 383,0 g/L (25 °C) 454,4 g/L (40 °C) 740,8 g/L (100 °C) |
|
| Termoquímica | ||
| ΔfH0sólido | -314.76 kJ/mol | |
| Peligrosidad | ||
| SGA |  |
|
| NFPA 704 |
0
2
0
|
|
| Frases H | H302 H319 | |
| Frases P | P264 P270 P280 P301+P312 P305+P351+P338 P330 P337+P313 P501 | |
| Compuestos relacionados | ||
| Otros aniones | Fluoruro de amonio Bromuro de amonio Yoduro de amonio |
|
| Otros cationes | Cloruro de sodio Cloruro de potasio Cloruro de hidroxilamonio |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El cloruro de amonio, también conocido como cloruro amónico o sal amoniacal, es una sal de amonio con la fórmula química NH4Cl. Es un compuesto que se presenta como cristales blancos y se disuelve muy bien en agua. Las soluciones de cloruro de amonio son un poco ácidas.
El nombre "sal amoniacal" se refiere a su forma natural, que se encuentra como un mineral. Este mineral suele formarse en lugares donde se quema carbón, a partir de los gases que se desprenden. También se puede encontrar cerca de algunos volcanes, en las zonas donde salen gases calientes.
Contenido
¿Cómo se descubrió el cloruro de amonio?
El cloruro de amonio, conocido antiguamente como sal amoníaco, ya era familiar en la época de los romanos. El escritor Plinio mencionó una sal llamada sal Hamoniaco. Esta sal se encontraba en lugares secos de África y era útil en la medicina. Aunque no estamos seguros de que fuera exactamente el cloruro de amonio actual, esta sal dio nombre a compuestos como el amoniaco y el amonio.
Durante mucho tiempo, la sal amoniacal se obtenía de depósitos naturales, especialmente en Asia Central. Más tarde, la que llegaba a Europa, traída por comerciantes, venía de zonas desérticas de Egipto. Allí se obtenía de materiales orgánicos. Un método similar se usó en Europa a partir del Renacimiento.
En el siglo XVIII, en 1756, James Davie y James Hutton empezaron a vender cloruro amónico en su fábrica de Edimburgo. Lo obtenían de una forma secreta, posiblemente de los residuos de las chimeneas de otras fábricas. Sin embargo, la mayor parte del cloruro amónico se seguía obteniendo de desechos orgánicos. Se hacía reaccionar el amoniaco con ácido clorhídrico.
A finales del siglo XVIII, se empezó a obtener cloruro amónico del carbonato de amonio que se encontraba en las aguas resultantes de la destilación del carbón. Se hacía reaccionar directamente con ácido clorhídrico. Antes de que se inventara el proceso de Haber-Bosch para producir amoniaco directamente, el cloruro amónico era muy importante en la química del amoniaco. Hoy en día, se fabrica combinando vapores de ácido clorhídrico y amoniaco.
¿Cómo se obtiene el cloruro de amonio?
El cloruro de amonio se produce como un subproducto en el proceso Solvay. Este proceso se usa para fabricar carbonato de sodio, un compuesto muy común. La reacción es:
Este método no solo es la forma principal de producir cloruro de amonio, sino que también ayuda a reducir la liberación de amoniaco en algunas industrias.
En un laboratorio, el cloruro de amonio se puede preparar mezclando amoníaco (NH3) con cloruro de hidrógeno (un gas) o ácido clorhídrico (en agua):
Como ya mencionamos, el cloruro de amonio también se forma de manera natural en zonas volcánicas. Allí, los cristales se depositan directamente del gas que sale de las fumarolas. Sin embargo, estos cristales no duran mucho porque se disuelven fácilmente en agua.
Propiedades del cloruro de amonio
¿Qué aspecto tiene y cómo se comporta?
Cuando el cloruro de amonio está en estado sólido, su color puede ser incoloro o blanco. No tiene olor, a diferencia del amoniaco. Es un material higroscópico, lo que significa que absorbe la humedad del aire.
Su punto de sublimación (cuando pasa directamente de sólido a gas) es de 350 °C. Su densidad es de 1,527 g/cm³.
¿Cómo reacciona con otras sustancias?
Cuando se calienta mucho, el cloruro de amonio parece que se convierte directamente en gas (sublima). Pero en realidad, se descompone en dos gases: amoníaco y cloruro de hidrógeno:
El cloruro de amonio es una sal que se comporta como un ácido débil. Por eso, si lo mezclas con una base fuerte, como el hidróxido de potasio, libera gas amoniaco:
También reacciona con algunos carbonatos de metales a altas temperaturas, produciendo amoniaco y cloruros de esos metales.
Si se mezcla con ácido sulfúrico o ácido fosfórico concentrados, que no se evaporan fácilmente, se forma gas cloruro de hidrógeno, que sí se evapora:
Usos del cloruro de amonio
Históricamente, el cloruro de amonio se usaba como medicamento. Sin embargo, su uso principal desde la antigüedad ha sido en el trabajo con metales.
¿Para qué se usa en la industria?
El cloruro de amonio es excelente para limpiar metales antes de soldarlos. También se usa para limpiar las puntas de cobre que se usan para soldar con estaño. Además, sirve para preparar láminas de hierro antes de cubrirlas con zinc o estaño.
Se emplea en la fabricación de pilas secas, como sustancia para fijar colores en tejidos (llamado mordiente) y en el lavado de pieles. También se utiliza para crear pátinas (capas de color) en el bronce, en la alimentación de animales, en el tratamiento de aguas y como aditivo alimentario.
Actualmente, el uso más importante del cloruro de amonio es como fuente de nitrógeno en los fertilizantes. Esto representa el 90% de su producción mundial. Se usa solo o combinado con fosfato de cloroamonio. Los cultivos más importantes que se fertilizan con él son el arroz y el trigo en Asia.
¿Se usa en la comida?
Sí, el cloruro de amonio se usa como aditivo alimentario. Se utiliza en la repostería y en masas fritas para que se hinchen y queden más esponjosas. Actúa como una especie de levadura química, como un acidificante y también como alimento para las levaduras biológicas. Además, puede cambiar ligeramente el sabor de los alimentos.
Es un ingrediente clave en dulces oscuros llamados "salmiak", populares en los países nórdicos. También se usa en la cocina para dar una textura crujiente a las galletas. En algunos países de Asia y Oriente Medio, se le llama "Noshader" y se usa para mejorar la frescura de aperitivos como las samosas y el jalebi. Es seguro usarlo en alimentos porque, a diferencia del amoniaco, no tiene olor y no es dañino en las cantidades permitidas.
¿Cómo se usaba en las pilas?
A principios del siglo XX, el cloruro de amonio se usaba disuelto en agua como electrolito en las pilas de Leclanché. Estas pilas fueron importantes comercialmente. Con el tiempo, evolucionaron a las pilas de zinc-carbono, que todavía usaban cloruro de amonio como electrolito. Fue el precursor de las pilas secas modernas.
¿Es peligroso el cloruro de amonio?
Cuando el cloruro de amonio se calienta mucho o se quema, se descompone. Produce humos que pueden ser tóxicos e irritantes, como óxidos de nitrógeno, amoniaco y cloruro de hidrógeno.
Cuando se disuelve en agua, forma un ácido débil. Puede reaccionar de forma violenta con nitrato amónico y clorato potásico, lo que puede causar incendios o explosiones. También reacciona con ácidos concentrados para formar cloruro de hidrógeno y con bases fuertes para formar amoniaco. Si se mezcla con sales de plata, puede formar compuestos sensibles a los golpes. Además, puede atacar al cobre y a otros compuestos.
¿Cómo se debe guardar?
Es importante guardar el cloruro de amonio separado de sustancias como el nitrato amónico, el clorato potásico, los ácidos, los álcalis, las sales de plata y el gasóleo. Se recomienda mantenerlo en un lugar seco para evitar que absorba humedad.
El cloruro de amonio y la escala Fahrenheit
El cloruro de amonio fue una referencia para crear la escala de temperatura Fahrenheit (°F).
El científico Fahrenheit estableció el "0" de su escala usando la temperatura más baja que se podía conseguir al mezclar cloruro de amonio, hielo y agua (aproximadamente -17,8 °C). Quería evitar tener temperaturas negativas, que eran comunes en otras escalas de la época. Como segundo punto de referencia, usó la temperatura de su propio cuerpo, definiéndola como 100 grados.
Galería de imágenes
Véase también
 En inglés: Ammonium chloride Facts for Kids
En inglés: Ammonium chloride Facts for Kids
- Sal amoniacal
- Cloruro de sodio
- Cloruro de potasio
- Amoníaco
- Cloro
- Salmiakki