Historia de la mecánica cuántica para niños
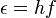 ); el modelo de J. J. Thomson en 1904, el postulado de luz cuántica de Albert Einstein en 1905 y el descubrimiento en 1907 del núcleo atómico positivo hecho por Ernest Rutherford.
); el modelo de J. J. Thomson en 1904, el postulado de luz cuántica de Albert Einstein en 1905 y el descubrimiento en 1907 del núcleo atómico positivo hecho por Ernest Rutherford.La historia de la mecánica cuántica es un viaje fascinante que nos ayuda a entender cómo funciona el mundo a nivel muy, muy pequeño, como los átomos y las partículas que los forman. Todo comenzó a finales del siglo XIX y principios del XX, cuando los científicos se dieron cuenta de que las leyes de la física que conocían no podían explicar algunos fenómenos.
Uno de los primeros pasos importantes lo dio Max Planck en 1900. Él propuso que la energía no se emite de forma continua, sino en "paquetes" o "cuantos" de energía. Imagina que la energía es como una escalera: no puedes estar en cualquier punto, solo en los escalones. Cada escalón es un "cuanto" de energía. Esta idea fue revolucionaria y sentó las bases de la mecánica cuántica.
En 1905, Albert Einstein usó la idea de Planck para explicar el efecto fotoeléctrico. Este efecto ocurre cuando la luz golpea ciertos materiales y hace que se liberen electrónes. Einstein sugirió que la luz no solo es una onda, sino que también está hecha de pequeñas partículas de energía, a las que más tarde se llamó fotones.
El término "mecánica cuántica" fue usado por primera vez por Max Born en un escrito llamado Zur Quantenmechanik (La Mecánica Cuántica). Con el tiempo, esta nueva forma de entender la energía y la materia se aplicó para explicar cómo se unen los átomos y cómo ocurren las reacciones químicas.
Contenido
- ¿Qué es la Mecánica Cuántica?
- Cronología de Descubrimientos Clave
- Experimentos Importantes en la Cuántica
- Galería de imágenes
- Véase también
- Enlaces externos
¿Qué es la Mecánica Cuántica?
La mecánica cuántica es una rama de la física que estudia el comportamiento de la materia y la energía a escalas muy pequeñas, como las de los átomos y las partículas subatómicas. A estas escalas, las reglas que conocemos del mundo "grande" (la física clásica) no siempre funcionan.
Los Primeros Pasos de la Cuántica
La idea de que la energía se comporta de forma "cuantizada" fue clave para el desarrollo de esta nueva física.
La Idea de los Cuantos de Energía
En 1900, el físico alemán Max Planck introdujo la idea de que la energía se emitía en "paquetes" discretos, no de forma continua. Esto le permitió explicar cómo los objetos calientes (llamados "cuerpos negros") emiten luz y calor. Cada uno de estos paquetes de energía es proporcional a la frecuencia de la radiación, y se calcula con la fórmula 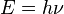 , donde
, donde 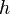 es la constante de Planck.
es la constante de Planck.
La Luz como Partículas: Los Fotones
En 1905, Albert Einstein profundizó en la idea de Planck. Él propuso que la luz, y toda la radiación electromagnética, está formada por pequeños "cuantos de energía" que se mueven como puntos en el espacio. Estos "cuantos de energía" fueron llamados fotones en 1926. Esta idea fue muy importante porque ayudó a entender que la luz tiene una doble naturaleza: a veces se comporta como una onda y a veces como una partícula.
El Átomo y la Cuantización
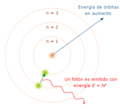
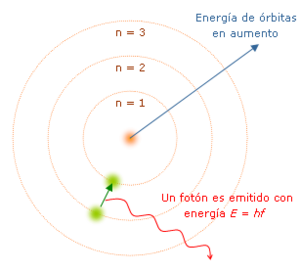
En 1913, Niels Bohr aplicó las ideas de la cuantización para explicar cómo se comportan los electrónes dentro de un átomo. Su modelo del átomo de hidrógeno sugería que los electrones giran alrededor del núcleo atómico en órbitas fijas, como si fueran escalones. Los electrones solo pueden estar en estas órbitas específicas, y cuando saltan de una órbita a otra, emiten o absorben energía en forma de cuantos.
El Nacimiento de la Mecánica Cuántica Moderna
Las primeras teorías cuánticas, aunque exitosas, eran solo un comienzo. La verdadera mecánica cuántica moderna nació en la década de 1920.
La Dualidad Onda-Partícula
En 1924, el físico francés Louis-Victor de Broglie propuso que las partículas, como los electrones, también pueden comportarse como ondas. Esta idea, conocida como la dualidad onda-partícula, fue fundamental.
La Incertidumbre y las Ecuaciones Clave
Basándose en la idea de De Broglie, la mecánica cuántica moderna se desarrolló rápidamente. En 1925, los físicos alemanes Werner Heisenberg y Max Born crearon la mecánica matricial. Al mismo tiempo, el físico austriaco Erwin Schrödinger inventó la mecánica de ondas y su famosa ecuación, que describe cómo se comportan las ondas de las partículas. Más tarde, Schrödinger demostró que ambos enfoques eran equivalentes.
En 1927, Heisenberg formuló su principio de incertidumbre, que dice que no podemos conocer con total precisión la posición y la velocidad de una partícula al mismo tiempo. Es como si al intentar medir una, afectáramos la otra.
La Cuántica en la Química
La mecánica cuántica también revolucionó la química. En 1927, los físicos Walter Heitler y Fritz London usaron la mecánica cuántica para explicar cómo se forman los enlaces covalentes entre los átomos, como en la molécula de hidrógeno. Esto ayudó a entender por qué los átomos se unen de ciertas maneras para formar moléculas. Científicos como Linus Pauling y John C. Slater continuaron desarrollando la química cuántica.
El Desarrollo de las Teorías Cuánticas de Campo
A partir de 1927, los científicos comenzaron a aplicar la mecánica cuántica no solo a partículas individuales, sino a "campos" de energía. Esto llevó al desarrollo de las teorías cuánticas de campo. Un gran avance fue la electrodinámica cuántica (QED), desarrollada por Richard Feynman, Freeman Dyson, Julian Schwinger y Shin'ichirō Tomonaga en la década de 1940. La QED describe cómo interactúan los electrones, los positrones y la luz. Esta teoría sirvió de modelo para otras teorías de campo cuántico, como la cromodinámica cuántica, que explica las fuerzas dentro del núcleo de los átomos.
Cronología de Descubrimientos Clave
Aquí tienes una tabla con algunos de los momentos y personas más importantes en la historia de la teoría cuántica:
| Fecha | Persona | Contribución |
| 1771 | Luigi Galvani | Observó que los músculos de ranas muertas se movían con electricidad, llamándolo "electricidad animal". |
| 1800 | Alessandro Volta | Inventó la pila voltaica o batería. |
| 1807 | John Dalton | Formuló la teoría de que la materia está compuesta de átomos con diferentes masas que se combinan. |
| 1838 | Michael Faraday | Descubrió los rayos catódicos al pasar corriente por un tubo de vidrio con aire enrarecido. |
| 1852 | Edward Frankland | Inició la teoría de la valencia, proponiendo que cada elemento tiene un poder de combinación específico. |
| 1859 | Gustav Kirchhoff | Planteó el "problema del cuerpo negro": cómo la intensidad de la radiación depende de la frecuencia y la temperatura. |
| 1877 | Ludwig Boltzmann | Sugirió que los estados de energía de un sistema físico deberían ser discretos. |
| 1879 | William Crookes | Mostró que los rayos catódicos pueden ser desviados por un campo magnético. |
| 1885 | Johann Jakob Balmer | Descubrió una serie de líneas en el espectro del hidrógeno. |
| 1888 | Johannes Rydberg | Modificó la fórmula de Balmer para incluir otras series de líneas. |
| 1891 | Alfred Werner | Propuso una teoría de afinidad y valencia basada en la fuerza atractiva del átomo. |
| 1892 | Heinrich Rudolf Hertz | Mostró que los rayos catódicos podían pasar a través de láminas delgadas de oro. |
| 1896 | Henri Becquerel | Descubrió la "radiactividad", la emisión espontánea de energía por ciertos elementos. |
| 1897 | Joseph John Thomson | Descubrió el electrón y propuso el modelo del "budín de ciruelas" para el átomo. |
| 1900 | Max Planck | Sugirió que la energía electromagnética se emite en "cuantos" (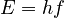 ) para explicar la radiación de cuerpo negro. ) para explicar la radiación de cuerpo negro. |
| 1902 | Gilbert N. Lewis | Desarrolló el modelo del átomo cúbico para explicar la regla del octeto. |
| 1904 | Richard Abegg | Notó un patrón en la valencia de los elementos (regla de Abegg). |
| 1905 | Albert Einstein | Postuló que la luz está formada por partículas cuánticas individuales (fotones) para explicar el efecto fotoeléctrico. |
| 1907 | Ernest Rutherford | Descubrió que los átomos tienen un pequeño núcleo atómico cargado positivamente en su centro. |
| 1913 | Niels Bohr | Postuló que los electrones giran en órbitas fijas alrededor del núcleo, explicando el espectro del átomo de hidrógeno. |
| 1916 | Arnold Sommerfeld | Sugirió que podría haber "órbitas elípticas" en los átomos. |
| 1919 | Irving Langmuir | Acuñó el término "covalencia" y postuló los enlaces de coordinación. |
| 1922 | Stern y Gerlach | El experimento de Stern y Gerlach detectó valores discretos de momentos angulares, llevando al descubrimiento del espín del electrón. |
| 1923 | Louis-Victor de Broglie | Postuló que los electrones en movimiento están asociados a longitudes de onda. |
| 1925 | Friedrich Hund | Resumió la "regla de máxima multiplicidad" sobre cómo los electrones ocupan los orbitales. |
| 1925 | Wolfgang Ernst Pauli | Resumió el "principio de exclusión de Pauli", que dice que dos partículas idénticas no pueden ocupar el mismo estado cuántico. |
| 1926 | Erwin Schrödinger | Desarrolló una "ecuación de onda" que representa la distribución de la carga de un electrón. |
| 1927 | Walter Heitler | Usó la ecuación de onda de Schrödinger para explicar cómo dos átomos de hidrógeno forman un enlace covalente. |
| 1927 | Robert S. Mulliken | Trabajó en la teoría orbital molecular e introdujo términos como enlace sigma y enlace pi. |
| 1928 | Linus Pauling | Resumió la naturaleza del enlace químico usando la mecánica cuántica. |
| 1929 | John Lennard-Jones | Introdujo una aproximación para calcular orbitales moleculares. |
| 1932 | Werner Heisenberg | Aplicó la teoría de perturbaciones para explicar la interacción de intercambio. |
| 1938 | Charles Coulson | Realizó el primer cálculo preciso de una función de onda de orbitales moleculares para la molécula de hidrógeno. |
| 1951 | Roothaan y Hall | Obtuvieron las ecuaciones de Roothaan-Hall, sentando las bases para métodos rigurosos de orbitales moleculares. |
Experimentos Importantes en la Cuántica
Muchos experimentos ayudaron a los científicos a entender el mundo cuántico:
- El experimento de la doble rendija de Thomas Young (c1805) mostró que la luz se comporta como una onda.
- Henri Becquerel descubrió la radiactividad (1896).
- El experimento del tubo de rayos catódicos de Joseph John Thomson (1897) llevó al descubrimiento del electrón.
- El estudio de la radiación de cuerpo negro (1850-1900) no podía explicarse sin las ideas cuánticas.
- El efecto fotoeléctrico: Albert Einstein lo explicó en 1905 usando los fotones.
- El experimento de la gota de aceite de Robert Andrews Millikan (1909) mostró que la carga eléctrica existe en unidades enteras.
- El experimento de la lámina de oro de Ernest Rutherford (1911) demostró que los átomos tienen un núcleo pequeño y denso.
- El experimento de Stern y Gerlach (1922) demostró la naturaleza cuantizada del espín de las partículas.
- Clinton Joseph Davisson y Lester Germer demostraron que los electrones también se comportan como ondas en el experimento de la difracción de electrones (1927).
- Clyde Cowan y Frederick Reines confirmaron la existencia del neutrino (1955).
- El experimento de la doble rendija de Claus Jönsson con electrones.
- El efecto cuántico de Hall, descubierto por Klaus von Klitzing en 1980, que permitió una definición muy precisa de la resistencia eléctrica.
- La verificación experimental del entrelazamiento cuántico realizada por Alain Aspect en 1982.
Galería de imágenes
-
El modelo cuántico del átomo de Niels Bohr desarrollado en 1913, el cual incorporó una explicación a la fórmula de Johannes Rydberg de 1888; la hipótesis cuántica de Max Planck de 1900, esto es, que los radiadores de energía atómica tienen valores de energía discreta (
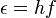 ); el modelo de J. J. Thomson en 1904, el postulado de luz cuántica de Albert Einstein en 1905 y el descubrimiento en 1907 del núcleo atómico positivo hecho por Ernest Rutherford.
); el modelo de J. J. Thomson en 1904, el postulado de luz cuántica de Albert Einstein en 1905 y el descubrimiento en 1907 del núcleo atómico positivo hecho por Ernest Rutherford.
Véase también
 En inglés: History of quantum mechanics Facts for Kids
En inglés: History of quantum mechanics Facts for Kids
Enlaces externos
zh:物理学史#量子理论