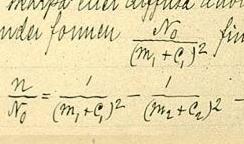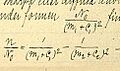Johannes Rydberg para niños
Datos para niños Johannes Rydberg |
||
|---|---|---|
 Johannes Rydberg
|
||
| Información personal | ||
| Nombre de nacimiento | Johannes Robert Rydberg | |
| Nacimiento | 8 de noviembre de 1854 Halmstad (Suecia) |
|
| Fallecimiento | 28 de diciembre de 1919 Lund Cathedral parish (Suecia) |
|
| Sepultura | Cementerio del Norte, Lund | |
| Nacionalidad | Sueco | |
| Educación | ||
| Educado en | Universidad de Lund | |
| Información profesional | ||
| Área | Física | |
| Conocido por | Fórmula de Rydberg | |
| Empleador | Universidad de Lund | |
| Obras notables |
|
|
| Miembro de | Royal Society (desde 1919) | |
| Distinciones |
|
|
Johannes Robert Rydberg (nacido en Halmstad, Suecia, el 8 de noviembre de 1854 y fallecido en Lund, Suecia, el 28 de diciembre de 1919) fue un físico sueco. Es muy conocido por crear la fórmula de Rydberg en 1888. Esta fórmula ayuda a predecir la longitud de onda de la luz y otras radiaciones que se emiten cuando los electrones cambian de nivel de energía en un átomo.
Trabajó en la Universidad de Lund en Suecia durante toda su vida.
Contenido
Biografía de Johannes Rydberg
Johannes Rydberg fue el único hijo de Sven Rydberg, un comerciante, y Maria Anderson Rydberg. Cuando Johannes tenía solo cuatro años, su padre falleció. Esto hizo que él y su madre tuvieran que vivir con pocos recursos económicos.
Desde 1864 hasta 1873, Johannes estudió en la escuela primaria de Halmstad. En su examen de ingreso, obtuvo las calificaciones más altas en matemáticas y física. En 1873, comenzó sus estudios en la Universidad de Lund. En 1875, obtuvo su licenciatura en filosofía. Durante sus estudios, recibió becas que le ayudaron a cubrir sus gastos.
Carrera científica de Rydberg
Rydberg comenzó su carrera profesional en 1876, mientras aún estudiaba. Se convirtió en profesor asistente en el departamento de física de la Universidad de Lund. En 1879, obtuvo su título de Doctor en Filosofía con una tesis sobre geometría.
En 1880, fue nombrado profesor asociado de matemáticas. Empezó a enseñar a estudiantes universitarios, pero siguió siendo profesor asistente. En 1882, se convirtió en profesor asociado de física en la Universidad de Lund. Poco después, también fue asistente de investigación.
En esa época, Rydberg empezó a investigar por qué los pesos atómicos en la tabla periódica de Dmitri Mendeléyev no seguían un patrón simple. No encontró una función matemática que lo explicara.
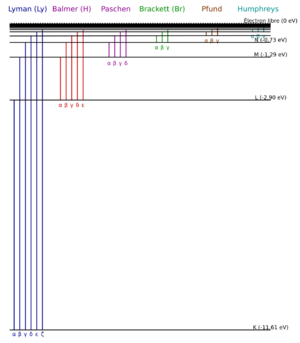
Su siguiente trabajo fue estudiar los espectros de los elementos. Quería entender por qué aparecían ciertas líneas de color. En 1885, el matemático suizo Johann Jakob Balmer presentó una fórmula que describía las líneas de luz del hidrógeno.
En 1887, Rydberg publicó su propia fórmula. Fue la primera que pudo describir las líneas de luz no solo para el hidrógeno, sino también para otros elementos. En 1890, publicó su trabajo principal, "Investigación sobre la constitución de los espectros de emisión de los elementos químicos". Estaba seguro de que sus leyes se aplicaban a todos los elementos.
Cuando hubo una vacante para profesor de física en 1897, Rydberg solicitó el puesto. Aunque tenía muy buenas recomendaciones, el puesto fue para otro científico. Sin embargo, en 1901, Rydberg se convirtió en profesor extraordinario y jefe de departamento. Para ganar más dinero, trabajó a tiempo parcial en un banco y como actuario.

En 1906 y 1908, se descubrieron nuevas series de líneas de luz para el hidrógeno. Estas series encajaban perfectamente con la ecuación de Rydberg. Esto convenció a las autoridades suecas de que Rydberg merecía ser profesor titular de física, y lo nombraron en 1909.
¿Qué es la Fórmula de Rydberg?
La Fórmula de Rydberg es una ecuación matemática que permite calcular la longitud de onda de la luz emitida por un átomo cuando sus electrones cambian de un nivel de energía a otro. Es muy útil en el estudio de los espectros de los elementos.
La constante física conocida como Constante de Rydberg lleva su nombre. También existe la unidad de Rydberg. Los átomos que están muy "excitados" (con electrones en niveles de energía muy altos) se llaman átomos de Rydberg.
El trabajo de Rydberg fue muy importante. En 1913, Niels Bohr desarrolló un modelo del átomo que explicaba por qué la fórmula de Rydberg funcionaba. Esto demostró que estudiar los espectros podía ayudar a entender cómo funcionan los átomos y sus propiedades químicas.
Legado e influencia de Rydberg
Rydberg descubrió una ley que explicaba los datos experimentales, pero no sabía exactamente por qué funcionaba a nivel físico. Fue Niels Bohr quien, en 1913, explicó la fórmula de Rydberg con su modelo del átomo de hidrógeno.
Lamentablemente, ese mismo año, Rydberg enfermó gravemente. Tuvo que reducir su trabajo y, en 1915, lo dejó por completo. Falleció el 28 de diciembre de 1919. Su antiguo alumno, Manne Siegbahn, lo sucedió como profesor de física en la Universidad de Lund. Rydberg está enterrado en el Cementerio Norte de Lund.
Aunque Rydberg no recibió el Premio Nobel, su trabajo fue muy valorado a nivel internacional. La Royal Society de Londres lo nombró miembro extranjero en 1919. Cuando Niels Bohr recibió el Premio Nobel de Física en 1922, mencionó a Rydberg varias veces en su discurso, rindiéndole homenaje.
En julio de 1954, se celebró una conferencia en la Universidad de Lund para celebrar el centenario del nacimiento de Rydberg. Asistieron muchos físicos importantes de la época, incluyendo a Niels Bohr y Wolfgang Pauli.
En honor a Johannes Rydberg, se nombraron el cráter lunar Rydberg y el asteroide (10506) Rydberg.
Galería de imágenes
Véase también
 En inglés: Johannes Rydberg Facts for Kids
En inglés: Johannes Rydberg Facts for Kids
- Fórmula de Rydberg
- Constante de Rydberg
- Átomo de Rydberg
- Modelo atómico de Bohr