Compuesto inorgánico para niños
Un compuesto químico inorgánico es un tipo de sustancia formada por diferentes elementos. A diferencia de los compuestos orgánicos, su componente principal no siempre es el carbono. El agua es un ejemplo muy común de compuesto inorgánico. En estos compuestos, pueden participar casi todos los elementos que conocemos.
Mientras que los compuestos orgánicos se forman de manera natural en animales y vegetales (y también pueden crearse en laboratorios), los compuestos inorgánicos se forman por procesos naturales como la electrólisis (separación de sustancias con electricidad) o la fusión (cuando algo se derrite). La energía solar, el agua y el oxígeno también ayudan a crear estas sustancias.
Los enlaces que unen los átomos en los compuestos inorgánicos suelen ser iónicos o covalentes.
Aquí tienes algunos ejemplos de compuestos inorgánicos:
- El cloruro de sodio (NaCl), que es la sal de mesa, tiene una molécula con un átomo de sodio y uno de cloro.
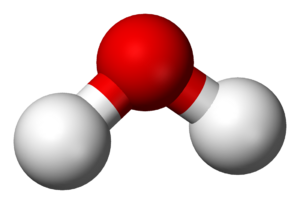
- El agua (H2O) tiene una molécula con dos átomos de hidrógeno y uno de oxígeno.
- El amoníaco (NH3) tiene una molécula con un átomo de nitrógeno y tres de hidrógeno.
- El dióxido de carbono (CO2) está en el aire. Los seres vivos lo liberan al respirar. Su molécula tiene un átomo de carbono y dos de oxígeno. Las plantas lo usan para la fotosíntesis. Aunque tiene carbono, no es orgánico porque no tiene hidrógeno.
Contenido
¿Qué elementos forman los compuestos inorgánicos?
Aunque los compuestos inorgánicos pueden incluir los 93 elementos naturales de la tabla periódica, son menos variados y numerosos que los compuestos orgánicos.
Los compuestos orgánicos están hechos principalmente de carbono (C), hidrógeno (H), oxígeno (O), nitrógeno (N) y azufre (S). Son muy numerosos porque el carbono puede formar cadenas muy largas y ramificadas.
Metales en los compuestos inorgánicos
Más del 75% de los elementos de la tabla periódica son metales.
Desde hace miles de años, la gente ha extraído metales como el estaño, el cobre, la plata y el hierro de los minerales. Esto se hacía calentando los minerales a temperaturas muy altas.
Todos los metales, excepto el mercurio, son sólidos a temperatura ambiente y se pueden derretir con calor. Los metales derretidos son fáciles de moldear para hacer objetos, y esto se sigue usando mucho hoy en día. Los metales son buenos conductores del calor y la electricidad.
A partir del siglo XIX, se empezó a obtener metales usando electricidad, como el aluminio y otros metales.
Hoy en día, se usan metales ligeros como el aluminio o el titanio para fabricar aviones, coches y trenes, así consumen menos energía. El hierro es muy usado en la construcción de coches por su dureza y resistencia al calor. Para evitar que el hierro se oxide (se oxide), muchos vehículos modernos tienen un recubrimiento especial.
Los metales también se usan en pilas y acumuladores para generar electricidad. Por ejemplo, las pilas de zinc-carbono usan zinc que se oxida para producir energía.
Las aleaciones son mezclas de metales que a veces tienen mejores propiedades que los metales puros. Por ejemplo, el duraluminio es una mezcla de magnesio, cobre y aluminio, y es más duro que el aluminio solo. El bronce (cobre y estaño) y el acero (hierro con otros elementos) son otras aleaciones importantes.
Algunos metales se combinan con no metales para formar cristales con nuevas propiedades. Por ejemplo, el silicio se usa en la electrónica para hacer semiconductores como los diodos.
Sales y minerales inorgánicos
El agua es muy importante en la química inorgánica. Sus átomos están unidos por enlaces especiales que le permiten disolver muchas sales inorgánicas. Gracias a que el agua puede disolver sustancias, la vida es posible en nuestro planeta.
Las sales inorgánicas se disuelven de forma diferente en el agua. Por ejemplo, si mezclas dos sales que se disuelven bien, a veces se puede formar una sal que no se disuelve y se separa de la mezcla.
Las rocas y los minerales también contienen metales, a menudo en forma de silicatos, que no se disuelven en agua.
El hormigón es un ejemplo importante de cómo se usan los silicatos. Se hace mezclando arcilla (que tiene silicatos de aluminio) con cal para crear cemento. Luego, se mezcla el cemento con grava y piedra triturada para hacer hormigón, que se usa en casi todos los edificios.
La porcelana se hace con un tipo de arcilla llamada caolín, que se mezcla con cuarzo y feldespato y se cuece a altas temperaturas.
El vidrio se forma calentando arena de cuarzo con una sal llamada sosa a más de 1000 °C.
Las sales que no se disuelven fácilmente se han usado como pigmentos para dar color a las pinturas.
Las sales inorgánicas también son muy importantes como fertilizantes para las plantas. Ayudan a que el suelo sea más fértil.
¿Cómo se nombran y formulan los compuestos inorgánicos?
Los compuestos inorgánicos tienen muchas estructuras diferentes.
Según cuántos átomos tienen sus moléculas, se clasifican así:
- Monoatómicas: Tienen un solo átomo, como los gases nobles (helio, neón).
- Diatómicas: Tienen dos átomos, como el dihidrógeno (H2) o el dioxígeno (O2).
- Triatómicas: Tienen tres átomos, como el ozono (O3), el agua (H2O) o el dióxido de carbono (CO2).
- Poliatómicas: Tienen cuatro o más átomos, como el fósforo (P4) o el óxido férrico (Fe2O3).
Compuestos binarios
Un compuesto binario está formado por solo dos elementos químicos.
Óxidos
Los óxidos se forman cuando el oxígeno se une a cualquier otro elemento, ya sea un metal (óxidos básicos) o un no metal (óxidos ácidos). Ejemplos:
- Óxido de cloro (VII): Cl2O7
- Dióxido de carbono: CO2
Peróxidos
Los peróxidos se forman cuando un grupo especial de oxígeno (O2-2) se une a un metal. En los peróxidos, el oxígeno tiene una valencia de -1. Ejemplos:
- Peróxido de litio: Li2O2
Hidruros
Los hidruros se forman cuando el hidrógeno se une a un metal. Ejemplos:
- Hidruro de litio: LiH
- Hidruro de berilio: BeH2
Sales binarias
Las sales binarias son combinaciones de un metal y un no metal. Ejemplos:
- Cloruro de calcio: CaCl2
- Bromuro de hierro (III): FeBr3
Compuestos ternarios
Un compuesto ternario tiene tres elementos diferentes.
Hidróxidos
Los hidróxidos se forman cuando un grupo hidroxilo (OH-) se une a un metal. Ejemplos:
- Hidróxido de sodio: NaOH
- Hidróxido de cobalto (III): Co(OH)3
Oxácidos
Los oxácidos son compuestos ternarios que se forman al combinar un óxido ácido con agua.
¿Cómo se descubrió la química inorgánica?
Desde la antigüedad, la gente ya conocía muchas sustancias inorgánicas. Sabían cómo extraer metales como el oro, la plata y el hierro de los minerales. También hacían cerámica, vidrio (en Egipto) y porcelana (en China). Usaban minerales para hacer colores y sales como la sal de cocina.
En el siglo XIII, los alquimistas árabes ya sabían cómo producir ácido sulfúrico, ácido clorhídrico y ácido nítrico. Estos ácidos se usaban para disolver metales.
Más tarde, en el siglo XVII, Johann Rudolph Glauber mejoró la forma de producir ácidos.
Robert Boyle, en su libro "El químico escéptico", propuso que los elementos están hechos de pequeños átomos idénticos, y que los compuestos químicos están hechos de diferentes elementos.
A principios del siglo XVIII, Georg Ernst Stahl y Johann Joachim Becher desarrollaron la teoría del flogisto, que intentaba explicar la combustión. Aunque esta teoría resultó ser incorrecta, fue un paso importante.
Joseph Priestley descubrió que el aire contenía una sustancia que ayudaba a la respiración y a la oxidación de los metales. Calentando óxido de mercurio(II), Priestley pudo extraer esta sustancia en forma de gas. Más tarde, Antoine Laurent de Lavoisier concluyó que esta sustancia era un nuevo elemento: el oxígeno. Lavoisier también descubrió que la masa total de las sustancias no cambia durante una reacción química (ley de conservación de la masa).
El descubrimiento de la electricidad por Luigi Galvani y Alessandro Volta permitió descomponer el agua en oxígeno e hidrógeno, lo que ayudó a entender su composición.
Humphry Davy usó la electricidad para separar nuevos elementos como el sodio y el potasio. John Dalton creó la primera tabla de pesos atómicos de los elementos. Jöns Jacob Berzelius desarrolló un sistema para nombrar los elementos con una o dos letras latinas.
Más tarde, Lothar Meyer y Dimitri Mendeleev organizaron los elementos químicos en una tabla periódica según su peso atómico y su capacidad de unirse. Esto hizo más fácil predecir cómo se comportarían los elementos y encontrar los que aún no se conocían.
Svante Arrhenius, Jacobus Henricus van 't Hoff y Wilhelm Ostwald descubrieron que los ácidos, bases y sales se separan en iones cuando están en agua. Este descubrimiento fue clave para entender muchas reacciones químicas.
Galería de imágenes
Ver también
- Química inorgánica
- Nomenclatura química de los compuestos inorgánicos
- Compuesto orgánico
- Reacción química
- Mineral
- Lista de compuestos inorgánicos
Véase también
 En inglés: Inorganic compound Facts for Kids
En inglés: Inorganic compound Facts for Kids