Fusión (cambio de estado) para niños
Derretimiento, también conocido como fusión, es un proceso físico fascinante. Imagina un cubo de hielo que se convierte en agua líquida. Eso es el derretimiento. Ocurre cuando una sustancia cambia de estado sólido a líquido.
Este cambio sucede cuando la energía dentro de un sólido aumenta. Esto suele pasar al aplicarle calor o presión. Cuando la temperatura de la sustancia llega a un punto específico, llamado punto de fusión, las partículas (iones o moléculas) que estaban muy ordenadas en el sólido empiezan a moverse más libremente. Así, el sólido se transforma en un líquido.
Cuando una sustancia se derrite y se vuelve líquida, su viscosidad (lo "espesa" que es) generalmente disminuye si la temperatura sigue subiendo. Una excepción interesante es el azufre. Su viscosidad aumenta al principio debido a un proceso llamado polimerización, pero luego disminuye a temperaturas aún más altas.
Algunos compuestos especiales, llamados compuestos orgánicos, se derriten pasando por estados intermedios. Estos estados tienen un orden parcial entre el sólido y el líquido.
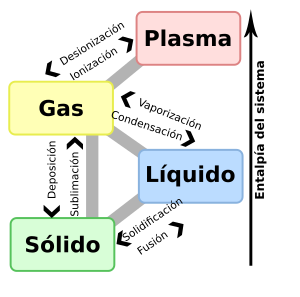
Piensa en un trozo de plomo. Si lo calientas, se derrite a una temperatura determinada. Si dejas que el plomo líquido se enfríe, volverá a ser sólido. Esto nos muestra que un sólido se vuelve líquido al calentarse, y un líquido se vuelve sólido al enfriarse. Cada sustancia química tiene una temperatura específica para este cambio. Cuando un sólido se convierte en líquido, esa temperatura se llama punto de fusión. Cuando un líquido se convierte en sólido, se llama solidificación. Los experimentos demuestran que el punto de fusión y el punto de solidificación son iguales para el mismo material bajo la misma presión.
Entre los metales puros, el estaño, el plomo y el bismuto se derriten a temperaturas más bajas. El mercurio es un caso especial, ya que es líquido a temperatura ambiente. Las aleaciones, que son mezclas de dos o más metales, suelen tener un punto de fusión más bajo que los metales que las componen. Por ejemplo, una aleación de zinc y plomo, usada para soldar, se derrite a unos 200 °C.
Contenido
Historia del derretimiento: ¿Cómo lo entendimos?
El concepto de derretimiento ha cambiado mucho a lo largo del tiempo. Desde las ideas antiguas sobre los estados de la materia hasta el conocimiento científico que tenemos hoy. La historia del derretimiento está conectada con el desarrollo de la termodinámica, la ciencia de los materiales y la teoría atómica.
Primeras ideas: Observaciones intuitivas
Las primeras ideas sobre el derretimiento vienen de civilizaciones antiguas. La gente veía cómo el hielo o los metales cambiaban de sólido a líquido. Los antiguos griegos, como Aristóteles, pensaban que la materia estaba hecha de cuatro elementos: tierra, aire, fuego y agua. Aunque no tenían un concepto formal de derretimiento, sabían que las sustancias cambiaban. Por ejemplo, el agua se congelaba en invierno y los metales se derretían al calentarse.
El Renacimiento y la Revolución Científica
Durante el Renacimiento, los estudiosos empezaron a cuestionar las ideas antiguas. Esto llevó a la revolución científica en los siglos XVI y XVII. Una figura importante fue Robert Boyle, quien sentó las bases de la química moderna. Sus estudios sobre los gases y su famosa Ley de Boyle ayudaron a entender la temperatura y la presión, que son clave para estudiar el derretimiento. Boyle y otros, como Isaac Newton, comenzaron a estudiar las propiedades de la materia con observación y experimentos.
En el siglo XVIII, científicos como Joseph Black y Jean-Pierre Méry estudiaron los cambios de fase del agua. Black descubrió el calor latente. Este es el calor necesario para cambiar la fase de una sustancia (de sólido a líquido, por ejemplo) sin cambiar su temperatura. Black demostró que el hielo absorbe calor al derretirse sin que su temperatura suba. Esto se explicó más tarde con el movimiento de las moléculas y la energía.
El nacimiento de la termodinámica
El siglo XIX fue muy importante para entender las transiciones de fase, como el derretimiento. Fue cuando la termodinámica se convirtió en una ciencia formal. Científicos como Sadi Carnot, James Clerk Maxwell y Rudolf Clausius crearon leyes sobre la conservación de la energía y la transferencia de calor. También se desarrolló el concepto de "punto crítico", que es la temperatura y presión donde las fases de la materia (como líquido y gas) se unen.
A mediados del siglo XIX, se empezó a entender la relación entre la temperatura y el comportamiento de los átomos y las moléculas. La teoría cinética de la materia, desarrollada por James Clerk Maxwell y Ludwig Boltzmann, explicó cómo se comportan las partículas en los diferentes estados. Según esta teoría, al aumentar la temperatura de un sólido, la energía de vibración de sus átomos o moléculas también aumenta. En algún momento, esta energía supera las fuerzas que los mantienen unidos, y así ocurre el derretimiento.
Comprensión moderna
En el siglo XX, con la mecánica cuántica y la teoría atómica, entendimos el derretimiento con más precisión. Ahora sabemos que las sustancias se derriten a una temperatura característica, el punto de fusión. Esta temperatura depende de la estructura molecular del material y de las fuerzas entre sus átomos. Por ejemplo, los metales suelen tener puntos de fusión altos porque los enlaces entre sus átomos son muy fuertes. En cambio, el hielo se derrite a temperaturas más bajas debido a los enlaces de hidrógeno entre las moléculas de agua, que son más débiles.
En la ciencia de materiales moderna, el derretimiento se entiende por el comportamiento de las moléculas y los átomos. Los puntos de fusión son una propiedad clave para identificar y describir sustancias. El estudio del derretimiento también se ha extendido a la cristalografía, que estudia cómo la disposición de los átomos en un sólido afecta su derretimiento, y al estudio de líquidos sobreenfriados y transiciones de vidrio.
El derretimiento como una transición de fase
Desde el punto de vista de la termodinámica, en el punto de fusión, la energía libre de Gibbs de las sustancias es cero. Sin embargo, hay cambios en la entalpía (calor latente de fusión) y la entropía. Por eso, el derretimiento se considera una transición de fase de primer orden. Ocurre cuando la energía libre de Gibbs del líquido es menor que la del sólido para ese material. La temperatura a la que esto sucede depende de la presión del ambiente.
El helio a bajas temperaturas es una excepción. El helio-3 tiene una entalpía de fusión negativa por debajo de 0.3 K. El helio-4 también tiene una entalpía de fusión ligeramente negativa por debajo de 0.8 K. Esto significa que, a presiones constantes, ¡hay que quitar calor de estas sustancias para que se derritan!
Criterios para el derretimiento
Para entender cuándo ocurre el derretimiento, se usan criterios teóricos como los de Lindemann y Born. El criterio de Lindemann dice que el derretimiento ocurre por una inestabilidad en las vibraciones. Los cristales se derriten cuando la vibración de sus átomos es muy grande comparada con la distancia entre ellos. El criterio de Born se basa en la pérdida de rigidez del material.
Sobreenfriamiento: ¿Qué pasa si no se congela?
Normalmente, el punto de fusión de una sustancia es una propiedad única. A menudo, el punto de fusión es igual al punto de congelación. Sin embargo, bajo ciertas condiciones, puede ocurrir el sobreenfriamiento o el sobrecalentamiento. Por ejemplo, el agua en un vaso muy limpio a menudo puede enfriarse varios grados por debajo de su punto de congelación sin congelarse. Pequeñas gotas de agua pura se han enfriado hasta -38 grados Celsius sin formar hielo. Esto ocurre si no hay algo que inicie el cambio, como una vibración física. Termodinámicamente, el líquido sobreenfriado está en un estado inestable y puede cristalizarse de repente.
Derretimiento de sólidos amorfos (vidrios)
Los vidrios son sólidos amorfos. Esto significa que sus moléculas no están ordenadas en una red regular como en un cristal. Se fabrican enfriando un material fundido muy rápidamente, sin darle tiempo a formar cristales. Los sólidos tienen una alta conexión entre sus moléculas, mientras que los líquidos tienen menos. El derretimiento de un material amorfo ocurre cuando los enlaces rotos forman un grupo que permite el flujo.
Incluso por debajo de su punto de fusión, pueden observarse películas casi líquidas en las superficies de los cristales. El grosor de esta película depende de la temperatura. Este efecto es común en todos los materiales cristalinos. La "prefusión" se ve en fenómenos como las heladas, el crecimiento de los copos de nieve y quizás incluso en el movimiento de los glaciares.
Conceptos relacionados
En genética, "derretir" el ADN significa separar la doble hélice del ADN en dos hebras individuales. Esto se hace calentándolo o usando agentes químicos, como en la reacción en cadena de la polimerasa.
Véase también
 En inglés: Melting Facts for Kids
En inglés: Melting Facts for Kids
- Lista de los elementos químicos con sus puntos de fusión
- Diagramas de fase