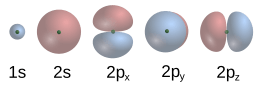Átomo para niños
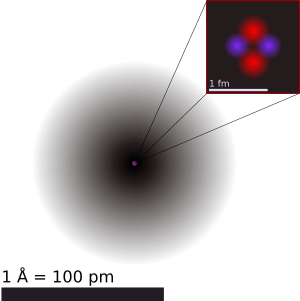
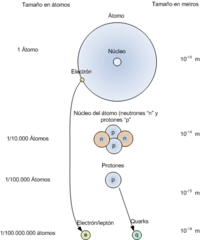
El átomo es la unidad más pequeña de un elemento químico que aún conserva sus propiedades. Los átomos son increíblemente pequeños, tan diminutos que no podemos verlos ni con los microscopios más potentes que usan luz. Su tamaño típico es de unos 100 picómetros, que es una diez mil millonésima parte de un metro. Debido a su tamaño, las reglas de la física que usamos para objetos grandes no funcionan bien para los átomos. Por eso, los científicos han desarrollado modelos especiales, basados en la física cuántica, para entender cómo se comportan.
La palabra "átomo" viene del latín atŏmus, que a su vez viene del griego antiguo átomon. Esta palabra significa "que no se puede cortar" o "indivisible". Fue usada por filósofos griegos como Demócrito de Abdera y Leucipo de Mileto hace mucho tiempo. Ellos creían que la materia estaba hecha de partículas tan pequeñas que no se podían dividir más.
Cada átomo tiene dos partes principales: un núcleo en el centro y una nube de electrones que lo rodea. El núcleo contiene dos tipos de partículas diminutas: los protones, que tienen carga eléctrica positiva, y los neutrones, que no tienen carga. El núcleo es muy denso y contiene casi toda la masa del átomo (más del 99.94%).
Alrededor del núcleo, en la nube de electrones, se encuentran los electrones. Estas partículas tienen carga eléctrica negativa. Si un átomo tiene el mismo número de protones y electrones, su carga total es neutra. Pero si tiene más o menos electrones que protones, entonces tiene una carga positiva o negativa y se llama ion. Toda la materia que nos rodea, ya sea sólida, líquida, gaseosa o plasma, está hecha de átomos o iones.
Los electrones son atraídos hacia los protones del núcleo por una fuerza llamada fuerza electromagnética. Dentro del núcleo, los protones y neutrones se mantienen unidos por otra fuerza, la fuerza nuclear fuerte, que es mucho más potente que la repulsión entre los protones positivos. Sin embargo, en algunos átomos muy grandes, la fuerza de repulsión puede ser más fuerte, haciendo que el núcleo sea inestable y se desintegre, liberando partículas y energía en un proceso llamado desintegración nuclear.
El número de protones en el núcleo es lo que define a qué elemento químico pertenece un átomo. Por ejemplo, todos los átomos de cobre tienen 29 protones. El número de neutrones define el isótopo de ese elemento. Los átomos pueden unirse entre sí mediante enlaces químicos para formar compuestos químicos, como moléculas. La forma en que los átomos se unen y se separan es la base de la química.
Existe también la antimateria, que está hecha de partículas con cargas opuestas a las de la materia normal. Por ejemplo, los antiprotones tienen carga negativa y los positrones tienen carga positiva. Cuando la materia y la antimateria se encuentran, se aniquilan, liberando una gran cantidad de energía. Sin embargo, la antimateria es muy rara en el universo. La mayor parte del universo no está hecha de átomos, sino de materia oscura y energía oscura, que son tipos de materia y energía que aún no entendemos completamente.
Contenido
- ¿Qué es el átomo?
- ¿Cómo se estructura un átomo?
- ¿Qué propiedades tienen los átomos?
- Historia de la teoría atómica: Un viaje de ideas
- Evolución del modelo atómico: Cómo ha cambiado nuestra idea del átomo
- Modelo de Dalton: Las esferas indivisibles
- Modelo de Thomson: El "pastel de pasas"
- Modelo de Nagaoka: El átomo como Saturno
- Modelo de Rutherford: El átomo planetario
- Modelo de Bohr: Órbitas cuantizadas
- Modelo de Sommerfeld: Órbitas elípticas
- Modelo de Schrödinger: La nube de probabilidad
- Modelo de Dirac: El espín del electrón
- Modelos posteriores: Más allá del núcleo
- Véase también
¿Qué es el átomo?

La idea de que la materia está hecha de bloques básicos e indivisibles llamados átomos surgió en la Antigua Grecia, alrededor del siglo V antes de Cristo. Filósofos como Demócrito fueron pioneros en esta forma de pensar.
Más tarde, Aristóteles propuso que la materia estaba formada por cuatro elementos (tierra, agua, aire y fuego) y no aceptó la idea de los átomos. Sin embargo, la teoría atomista fue mantenida por otras escuelas de pensamiento, como la de Epicuro, quien creía que los átomos tenían forma, tamaño y peso, se movían constantemente y se unían para formar todo lo que vemos.
Después de la Revolución científica, en el siglo XIX, los científicos retomaron la idea de los átomos para explicar las leyes de la química. Con el desarrollo de la física nuclear en el siglo XX, se descubrió que los átomos no son indivisibles, sino que están formados por partículas aún más pequeñas.
Los átomos son tan pequeños que solo pueden verse con instrumentos muy avanzados, como el microscopio de efecto túnel. Como mencionamos, casi toda la masa de un átomo se encuentra en su núcleo. Los electrones, que están en la nube alrededor del núcleo, se organizan en diferentes niveles de energía. Las transiciones de los electrones entre estos niveles pueden liberar o absorber radiación electromagnética en forma de fotones, lo cual es la base de la espectroscopia, una técnica para estudiar la composición de las sustancias.
¿Cómo se estructura un átomo?
Partículas subatómicas: Los componentes del átomo
Aunque la palabra "átomo" significa "indivisible", en realidad está formado por partículas aún más pequeñas llamadas partículas subatómicas. Estas se clasifican según su carga eléctrica:
- Protones: Tienen carga eléctrica positiva.
- Neutrones: No tienen carga eléctrica.
- Electrones: Tienen carga eléctrica negativa.
Los protones y neutrones se encuentran en el centro del átomo, formando el núcleo atómico. Por eso se les llama nucleones. Los electrones, en cambio, se mueven constantemente en una región alrededor del núcleo, conocida como nube de electrones. Una excepción es el átomo de hidrógeno-1, que no tiene neutrones.
El electrón es la partícula más ligera del átomo. Se considera una partícula elemental porque no se sabe que tenga subestructura. Los protones son unas 1836 veces más pesados que los electrones y tienen una carga positiva. Los neutrones son un poco más pesados que los protones y no tienen carga.
Es interesante saber que los protones y neutrones no son partículas elementales. Están formados por partículas aún más pequeñas llamadas quarks. Un protón tiene dos quarks "arriba" y un quark "abajo", mientras que un neutrón tiene dos quarks "abajo" y un quark "arriba". Estas partículas se mantienen unidas por la fuerza nuclear fuerte, que es mediada por gluones.
El núcleo atómico: El corazón del átomo
Los protones y neutrones están fuertemente unidos en el núcleo atómico, que es la parte central y más densa del átomo. El volumen del núcleo es muchísimo más pequeño que el tamaño total del átomo. Los nucleones se mantienen unidos por la fuerza nuclear, que es mucho más fuerte que la fuerza eléctrica que intenta separar a los protones con carga positiva.
Todos los átomos de un mismo elemento tienen el mismo número de protones, que se llama número atómico (Z). Sin embargo, pueden tener diferente número de neutrones; a estos se les llama isótopos.
El núcleo atómico puede cambiar en procesos de muy alta energía, como la desintegración radiactiva, donde los núcleos inestables emiten radiación y se transforman en otros elementos. Un núcleo pesado también puede dividirse en otros más ligeros (fisión nuclear), o dos o más núcleos ligeros pueden unirse para formar uno más pesado (fusión nuclear).
La nube de electrones: Donde los electrones "viven"
Los electrones son atraídos por los protones del núcleo debido a la fuerza electromagnética. Esta fuerza los mantiene "atrapados" alrededor del núcleo. Cuanto más cerca está un electrón del núcleo, más fuerte es la atracción y más energía se necesita para liberarlo.
Los electrones se comportan como partículas y como ondas al mismo tiempo. Alrededor del núcleo, forman ondas estacionarias. Cada una de estas ondas se describe con una función matemática llamada orbital atómico, que nos dice dónde es más probable encontrar un electrón en el espacio. La "nube de electrones" es la región donde estas ondas se encuentran, y se visualiza como una zona de carga negativa alrededor del núcleo.
Cada orbital tiene un nivel de energía específico. Los electrones se distribuyen en estos orbitales. El principio de exclusión de Pauli dice que no puede haber más de dos electrones en el mismo orbital. Los electrones pueden cambiar de un nivel de energía a otro: si absorben un fotón (una partícula de luz) con la energía adecuada, pueden saltar a un nivel superior; si caen a un nivel inferior, emiten un fotón. Las energías de estos fotones son las que vemos en las líneas espectrales de la luz que emiten o absorben los átomos.
¿Qué propiedades tienen los átomos?
Masa: El "peso" del átomo
La mayor parte de la masa de un átomo proviene de los nucleones (protones y neutrones) en su núcleo. La masa de los electrones también contribuye, pero en menor medida. La unidad de masa que se usa para los átomos es la unidad de masa atómica (u). Esta se define como la doceava parte de la masa de un átomo de carbono-12 (que tiene 6 protones y 6 neutrones). Un protón y un neutrón libres tienen una masa de aproximadamente 1 u. El átomo estable más pesado es el plomo-208, con una masa de casi 208 u.
En química, también se usa el mol como unidad. Un mol de átomos de cualquier elemento siempre contiene el mismo número de átomos (el Número de Avogadro, que es 6.022 x 1023). Esto significa que un mol de átomos de un elemento pesa aproximadamente tantos gramos como su masa atómica en unidades de masa atómica.
Tamaño: ¿Qué tan grandes son los átomos?
Los átomos no tienen un borde definido, por lo que su tamaño se refiere al de su nube electrónica. Como los electrones se comportan como ondas, tampoco es fácil medir su tamaño exacto. Por eso, el "radio atómico" se estima a partir de diferentes fenómenos físicos, como la distancia entre los núcleos en una molécula.
Los radios atómicos suelen estar entre 0.5 y 5 ángstroms (Å). En la tabla periódica, el tamaño de los átomos tiende a disminuir a lo largo de una fila (periodo) y a aumentar bruscamente al inicio de una nueva fila, cuando los electrones ocupan nuevos niveles de energía.
Los átomos son miles de veces más pequeños que la longitud de onda de la luz, por lo que no podemos verlos con microscopios ópticos. Para que te hagas una idea, el grosor de un cabello humano es como un millón de átomos de carbono puestos en fila. Si una manzana fuera tan grande como la Tierra, los átomos de esa manzana serían del tamaño de una manzana normal.
Niveles de energía: Los "escalones" de los electrones
Un electrón en un átomo tiene una energía potencial que depende de su distancia al núcleo. Cuanto más lejos está, más energía tiene. La energía se mide en electrónvoltios (eV). En el modelo cuántico, los electrones solo pueden estar en ciertos niveles de energía específicos, como si fueran escalones. El nivel de energía más bajo se llama estado fundamental, y los demás son estados excitados.
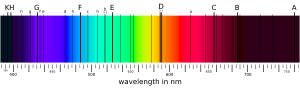
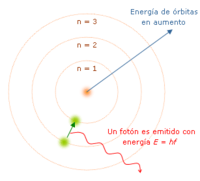
Cuando un electrón salta entre dos niveles de energía, absorbe o emite un fotón (una partícula de luz) cuya energía es exactamente la diferencia entre esos dos niveles. La energía de un fotón está relacionada con su frecuencia, por lo que cada salto de energía se corresponde con una banda estrecha en el espectro electromagnético llamada línea espectral.
Cada elemento químico tiene un patrón único de líneas espectrales. Estas líneas se pueden ver cuando los átomos emiten luz (líneas de emisión) o cuando absorben luz (líneas de absorción). Al estudiar estas líneas, los científicos pueden determinar de qué está hecha una sustancia.
Existen efectos más complejos, como la estructura fina, que hacen que algunas líneas espectrales que parecían una sola, en realidad estén formadas por varias líneas muy juntas. Esto se debe a pequeñas interacciones entre los electrones y el núcleo, como los efectos relativistas o la interacción del momento magnético del electrón.
Además, si un átomo se encuentra en un campo eléctrico (efecto Stark) o magnético (efecto Zeeman), sus niveles de energía pueden cambiar, lo que también afecta a las líneas espectrales.
Si un electrón absorbe un fotón con mucha energía, puede liberarse completamente del átomo, en un fenómeno llamado efecto fotoeléctrico. Los electrones también pueden caer a niveles de energía inferiores de forma espontánea, emitiendo un fotón, o de forma estimulada, donde un fotón "entrante" provoca que el electrón caiga y emita otro fotón idéntico. Este último proceso es la base del láser.
Interacciones eléctricas: ¿Por qué los electrones no caen al núcleo?
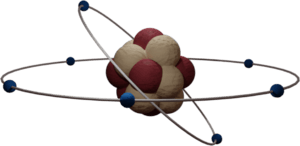
Antes de un experimento muy importante realizado por Ernest Rutherford en 1911, se pensaba que el átomo era como un "pastel de pasas", con cargas positivas y negativas mezcladas. Pero el experimento de Rutherford demostró que el átomo tiene un núcleo central positivo y electrones que giran a su alrededor.
Este modelo de Rutherford tenía un problema: según las leyes del electromagnetismo, una partícula cargada que se mueve en círculo (como un electrón orbitando) debería perder energía constantemente y, eventualmente, caer al núcleo. Esto significaría que los átomos serían inestables y se destruirían muy rápidamente, lo cual no ocurre en la realidad. Este problema llevó a nuevos descubrimientos y modelos atómicos.
Historia de la teoría atómica: Un viaje de ideas

La idea del átomo es muy antigua, propuesta por filósofos griegos como Demócrito, Leucipo y Epicuro. Ellos no hicieron experimentos, sino que pensaron que la materia debía estar hecha de unidades indivisibles e indestructibles que se combinaban de diferentes maneras para formar todo lo que vemos. Estas ideas fueron muy importantes para la química y la física modernas.
Un gran avance llegó en 1773 con el químico francés Antoine-Laurent de Lavoisier, quien postuló la ley de conservación de la masa: "La materia no se crea ni se destruye, solo se transforma". Más tarde, en 1804, el químico inglés John Dalton demostró esto con experimentos y concluyó que las sustancias están hechas de átomos esféricos, idénticos para cada elemento, pero diferentes entre elementos.
En 1811, el físico italiano Amedeo Avogadro propuso que, bajo las mismas condiciones, los gases tienen el mismo número de partículas, ya sean átomos o moléculas. Esto ayudó a distinguir entre átomos y moléculas.
El químico ruso Dmítri Ivánovich Mendeléyev creó en 1869 una clasificación de los elementos químicos basada en su masa atómica, notando que sus propiedades se repetían periódicamente. Este trabajo fue el origen de la tabla periódica actual.
La visión moderna de la estructura interna del átomo comenzó con el experimento de Rutherford en 1911. Su modelo atómico de Rutherford no podía explicar por qué los átomos eran estables o sus espectros de luz. Por eso, Niels Bohr propuso su modelo atómico de Bohr, que explicaba estos hechos, aunque no del todo. Descubrimientos posteriores, como la teoría cuántica y el microscopio electrónico, nos han permitido entender mucho mejor las propiedades de los átomos.
Evolución del modelo atómico: Cómo ha cambiado nuestra idea del átomo
Nuestra comprensión del átomo ha cambiado mucho a lo largo de la historia, gracias a nuevos descubrimientos en física y química. Aquí te mostramos algunos de los modelos atómicos más importantes que se han propuesto. Algunos ya no se usan para explicar lo que observamos hoy, pero son parte de la historia de la ciencia.
Modelo de Dalton: Las esferas indivisibles
Fue el primer modelo atómico basado en la ciencia, propuesto en 1803 por John Dalton. Él imaginaba los átomos como pequeñas esferas. Sus ideas principales eran:
- La materia está hecha de partículas muy pequeñas llamadas átomos, que no se pueden dividir ni destruir.
- Los átomos de un mismo elemento son idénticos y tienen el mismo peso y propiedades. Los átomos de diferentes elementos son distintos.
- Los átomos no se dividen en las reacciones químicas.
- Cuando los átomos se combinan para formar compuestos, lo hacen en proporciones sencillas.
- Los átomos de diferentes elementos pueden combinarse en distintas proporciones para formar varios compuestos.
- Los compuestos químicos se forman cuando se unen átomos de dos o más elementos diferentes.
Este modelo fue superado porque no podía explicar fenómenos como los rayos catódicos, la radiactividad o la existencia de electrones y protones.
Modelo de Thomson: El "pastel de pasas"
Después de que Joseph John Thomson descubriera el electrón en 1897, se supo que la materia tenía partes negativas y positivas. Thomson propuso que los electrones (partes negativas) estaban incrustados en una masa de carga positiva, como pasas en un pastel. Más tarde, Jean Perrin sugirió que los electrones estaban en la parte exterior de esa masa positiva.
Este modelo explicaba cómo se formaban los iones (átomos con carga), pero no podía explicar otras radiaciones.
Modelo de Nagaoka: El átomo como Saturno
Hantarō Nagaoka no estaba de acuerdo con el modelo de Thomson. En 1904, propuso un modelo alternativo donde un centro de carga positiva estaba rodeado por electrones que giraban, como el planeta Saturno y sus anillos. Él pensó que los anillos de Saturno eran muy estables porque el planeta era muy masivo. Este modelo sugería:
- Un núcleo muy masivo (como el planeta).
- Electrones girando alrededor del núcleo, unidos por fuerzas eléctricas (como los anillos unidos por la gravedad).
Modelo de Rutherford: El átomo planetario
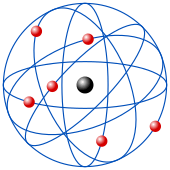
Este modelo fue desarrollado por el físico Ernest Rutherford en 1911, basándose en su famoso experimento. Fue un gran avance. Rutherford propuso que el átomo tiene una parte positiva concentrada en un núcleo muy pequeño y denso, que contiene casi toda la masa del átomo. Los electrones, con carga negativa, giran alrededor de este núcleo en órbitas, dejando un gran espacio vacío entre ellos. Aunque este modelo está obsoleto, es la imagen que mucha gente tiene del átomo.
Rutherford también predijo la existencia del neutrón en 1920.
Sin embargo, el modelo de Rutherford tenía problemas:
- Contradecía las leyes del electromagnetismo de James Clerk Maxwell. Según estas leyes, los electrones que giran deberían perder energía y caer al núcleo, haciendo que el átomo fuera inestable.
- No podía explicar los espectros atómicos (los patrones de luz que emiten o absorben los átomos).
Modelo de Bohr: Órbitas cuantizadas
Este modelo, propuesto por Niels Bohr, se basó en el de Rutherford, pero incorporó ideas de la teoría cuántica de Max Planck y el efecto fotoeléctrico de Albert Einstein. Bohr dijo que:
- El átomo es como un pequeño sistema solar, con un núcleo en el centro y electrones moviéndose en órbitas bien definidas.
- Las órbitas están "cuantizadas", lo que significa que los electrones solo pueden estar en ciertas órbitas específicas.
- Cada órbita tiene una energía asociada, y la más externa tiene la mayor energía.
- Los electrones no pierden energía mientras están en órbitas estables.
- Los electrones pueden saltar de una órbita a otra. Si saltan a una órbita de mayor energía, absorben una cantidad específica de energía. Si saltan a una de menor energía, liberan energía en forma de luz.
El mayor éxito de Bohr fue explicar el espectro de emisión del hidrógeno. Sin embargo, no pudo explicar por qué las órbitas eran estables o cómo se cuantizaba el momento angular del electrón.
Modelo de Sommerfeld: Órbitas elípticas
El modelo de Bohr funcionaba muy bien para el átomo de hidrógeno, pero no tan bien para otros elementos. Se observó que los electrones en un mismo nivel de energía podían tener energías ligeramente diferentes. Arnold Sommerfeld, usando la teoría de la relatividad de Albert Einstein, modificó el modelo de Bohr:
- Los electrones se mueven alrededor del núcleo en órbitas circulares o elípticas.
- A partir del segundo nivel de energía, existen dos o más "subniveles" con energías ligeramente diferentes.
- El electrón es como una pequeña corriente eléctrica.
Este modelo fue una mejora, pero aún no podía explicar completamente las formas de las órbitas elípticas.
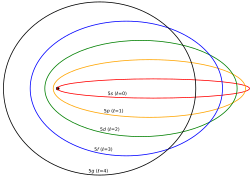
Modelo de Schrödinger: La nube de probabilidad
Después de que Louis-Victor de Broglie propusiera que la materia tiene propiedades de onda en 1924, y Erwin Schrödinger lo generalizara en 1926, el modelo del átomo se actualizó de nuevo.
En el modelo de Schrödinger, ya no se piensa en los electrones como pequeñas esferas que giran. En cambio, Schrödinger describe a los electrones con una función de onda. El cuadrado de esta función nos dice la probabilidad de encontrar al electrón en una región específica del espacio. Esta zona de probabilidad se llama orbital atómico. La imagen muestra los orbitales para los primeros niveles de energía del átomo de hidrógeno.
Modelo de Dirac: El espín del electrón
El modelo de Dirac es similar al de Schrödinger, pero usa una ecuación que tiene en cuenta la teoría de la relatividad. Esto permite incluir de forma natural el espín del electrón (una propiedad cuántica que se puede imaginar como si el electrón "girara" sobre sí mismo). Predice niveles de energía muy precisos.
Modelos posteriores: Más allá del núcleo
Después del modelo de Dirac, la teoría cuántica se desarrolló aún más. A partir de los años 1960 y 1970, surgieron modelos que explicaban las interacciones de los nucleones (protones y neutrones). La estructura electrónica de los átomos sigue siendo bien explicada por el modelo de Dirac. Sin embargo, la estructura del núcleo atómico es mucho más compleja. Existen modelos aproximados como el modelo de la gota líquida y el modelo de capas para entender el núcleo.
Más tarde, se descubrió que los propios nucleones (neutrones, protones) están formados por partículas aún más fundamentales llamadas quarks. Las interacciones entre quarks son muy complicadas. Aunque la estructura del núcleo y de sus partículas es muy compleja, las teorías actuales explican muy bien las propiedades químicas de la materia, ya que estas dependen principalmente de la estructura electrónica de los átomos.
Véase también
 En inglés: Atom Facts for Kids
En inglés: Atom Facts for Kids