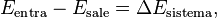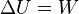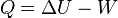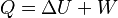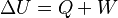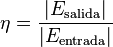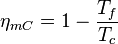Termodinámica para niños
La termodinámica es una rama de la física que estudia cómo la energía se mueve y se transforma. Se enfoca en cómo el calor se convierte en trabajo y viceversa, y cómo la materia cambia de estado (como de sólido a líquido o gas) cuando se le aplica calor o presión.
Esta ciencia nos ayuda a entender cómo funcionan muchas cosas a nuestro alrededor, desde los motores de los coches hasta cómo se calienta el agua. La termodinámica se basa en cuatro ideas principales, llamadas principios fundamentales:
- El Principio Cero: Habla del equilibrio térmico, es decir, cuando dos objetos alcanzan la misma temperatura.
- El Primer Principio: Trata sobre la conservación de la energía, explicando que la energía no se crea ni se destruye, solo se transforma.
- El Segundo Principio: Nos dice que los procesos naturales tienen una dirección y que la entropía (una medida del desorden) de un sistema aislado siempre tiende a aumentar.
- El Tercer Principio: Establece que es imposible alcanzar la temperatura más baja posible, el cero absoluto.
La termodinámica es muy útil en muchas áreas de la ciencia y la ingeniería, como en el diseño de motores, el estudio de las reacciones químicas y los cambios de fase de la materia.
Contenido
- ¿Cómo surgió la termodinámica?
- ¿De dónde viene la palabra "termodinámica"?
- Ramas de la termodinámica
- Principios fundamentales de la termodinámica
- Equilibrio térmico
- Variables termodinámicas
- Procesos termodinámicos
- Rendimiento termodinámico o eficiencia
- Instrumentos termodinámicos
- Variables conjugadas
- Campos de aplicación
- Diagramas termodinámicos
- Véase también
- Galería de imágenes
¿Cómo surgió la termodinámica?

La historia de la termodinámica es una parte muy importante de la historia de la física, la historia de la química y la ciencia en general. Como la termodinámica es relevante en muchas áreas, su historia está conectada con el desarrollo de la mecánica clásica, la mecánica cuántica, el magnetismo y la cinética química. También se aplica a campos como la meteorología, la teoría de la información y la biología (fisiología), y a avances tecnológicos como la máquina de vapor, el motor de combustión interna, la criogenia (tecnología de muy bajas temperaturas) y la generación de electricidad. El desarrollo de la termodinámica fue impulsado por la teoría atómica. Además, de forma sutil, motivó nuevas ideas en probabilidad y estadística.
La historia de la termodinámica como ciencia comenzó en 1650 con Otto von Guericke. Él construyó la primera bomba de vacío y demostró las propiedades del vacío usando sus hemisferios de Magdeburgo. Guericke quería demostrar que la idea de Aristóteles de que "la naturaleza aborrece el vacío" no era correcta. Poco después, el físico y químico Robert Boyle mejoró los diseños de Guericke y en 1656, junto con Robert Hooke, construyó una bomba de aire. Con esta bomba, Boyle y Hooke vieron una relación entre la presión, la temperatura y el volumen. Con el tiempo, se formuló la ley de Boyle, que dice que para un gas a temperatura constante, la presión y el volumen son inversamente proporcionales, y otras leyes de los gases.
En 1679, Denis Papin, un colega de Boyle, usó estas ideas para construir un "digestor de vapor". Era un recipiente cerrado donde el vapor alcanzaba alta presión, lo que aumentaba el punto de ebullición y cocinaba los alimentos más rápido.
En 1697, el ingeniero Thomas Savery, basándose en los diseños de Papin, construyó el primer motor térmico, seguido por Thomas Newcomen en 1712. Aunque estos primeros motores eran sencillos y no muy eficientes, llamaron la atención de los científicos más importantes de la época.
En 1733, Daniel Bernoulli usó métodos estadísticos y la mecánica clásica para entender la hidrodinámica, dando inicio a la física estadística.
En 1781, el profesor Joseph Black de la Universidad de Glasgow desarrolló los conceptos de capacidad calorífica y calor latente. James Watt, quien trabajaba allí como fabricante de instrumentos, consultó con Black sobre las pruebas de la máquina de vapor. Fue Watt quien tuvo la idea del condensador externo, lo que mejoró mucho la eficiencia de la máquina de vapor.
En 1783, Antoine Lavoisier propuso la teoría calórica.
En 1798, Benjamin Thompson, conde de Rumford, demostró que el trabajo mecánico se podía convertir en calor.

Basándose en todo este trabajo, Sadi Carnot, conocido como el "padre de la termodinámica", publicó en 1824 su libro Reflexiones sobre la energía motriz del fuego. En él hablaba sobre la eficiencia térmica, la energía y el motor. Este documento describió las relaciones básicas de energía entre la máquina de Carnot, el ciclo de Carnot y la energía motriz, marcando el inicio de la termodinámica como una ciencia moderna.
El primer libro de texto sobre termodinámica fue escrito en 1859 por William Rankine, quien era físico y profesor de ingeniería civil y mecánica. Los primeros dos principios de la termodinámica surgieron al mismo tiempo en la década de 1850, principalmente gracias a los trabajos de Germain Henri Hess, William Rankine, Rudolf Clausius, James Prescott Joule y William Thomson (Lord Kelvin).
Las bases de la termodinámica estadística fueron establecidas por físicos como James Clerk Maxwell, Ludwig Boltzmann, Max Planck, Rudolf Clausius, Johannes van der Waals y Josiah Willard Gibbs.
Entre 1873 y 1876, el físico matemático estadounidense Josiah Willard Gibbs publicó una serie de tres artículos, siendo el más famoso Sobre el equilibrio de las sustancias heterogéneas. Gibbs mostró cómo los procesos termodinámicos, incluyendo las reacciones químicas, podían ser analizados con gráficos. Al estudiar la energía, la entropía, el potencial químico, la temperatura y la presión de un sistema termodinámico, se puede saber si un proceso ocurrirá de forma espontánea. La termodinámica química y la fisicoquímica fueron desarrolladas más tarde por Walther Nernst, Pierre Duhem, Gilbert N. Lewis, Jacobus Henricus van 't Hoff y Théophile de Donder, entre otros, aplicando los métodos matemáticos de Gibbs.
También fueron importantes para la termodinámica los avances en la medición de la temperatura (termometría) y la presión (manometría).
¿De dónde viene la palabra "termodinámica"?
La palabra "termodinámica" tiene una historia interesante. Al principio se escribía con un guion ("termo-dinámica"). Entre 1854 y 1868, se convirtió en el sustantivo "termodinámica" para referirse a la ciencia de los motores de calor.
El biofísico estadounidense Donald Haynie dice que la palabra "termodinámica" se creó en 1840 a partir de dos palabras griegas: "therme", que significa "calor", y "dynamis", que significa "poder".
Algunos creen que James Prescott Joule acuñó el término en 1858, pero él nunca lo usó. En su lugar, habló de "motor termodinámico perfecto". Fue William Thomson (Lord Kelvin) quien usó "termodinámica" como un término común en un artículo de 1858 sobre la teoría de Carnot.
Ramas de la termodinámica
El estudio de la termodinámica se ha dividido en varias ramas, cada una con un enfoque diferente:
Termodinámica clásica
La termodinámica clásica describe los estados de los sistemas cuando están casi en equilibrio termodinámico. Utiliza propiedades que podemos medir a gran escala, como la temperatura o la presión. Esta rama se desarrolló en el siglo XIX y nos ayuda a entender cómo se intercambian la energía, el trabajo y el calor basándose en los principios de la termodinámica.
Física estadística
La física estadística, también llamada termodinámica estadística, surgió a finales del siglo XIX y principios del XX. Complementa la termodinámica clásica al explicar las interacciones entre las partículas más pequeñas, como los átomos y las moléculas. Esta rama conecta lo que ocurre a nivel microscópico con las propiedades que observamos a simple vista en los materiales.
Termodinámica química
| Ingeniería química | |
|---|---|
 |
|
| Generalidades | |
|
|
| Fundamentos | |
| Aspectos | |
|
|
| Procesos Unitarios | |
|
|
| Glosarios | |
|
|
La Termodinámica química estudia la relación entre el calor y el trabajo en las reacciones químicas o en los cambios físicos de la materia, siguiendo las leyes de la termodinámica. Esta rama no solo mide propiedades termodinámicas en el laboratorio, sino que también usa métodos matemáticos para estudiar preguntas y reacciones químicas.
La termodinámica química se basa en el primer y segundo principio de la termodinámica. A partir de ellos, se pueden obtener ecuaciones matemáticas que ayudan a entender las propiedades termodinámicas de un sistema termodinámico.
Termodinámica del equilibrio
Esta rama estudia cómo la materia y la energía se mueven en sistemas que pueden pasar de un estado de equilibrio a otro. El "equilibrio termodinámico" significa que no hay cambios importantes ni flujos de materia o energía dentro del sistema.
La termodinámica de no equilibrio estudia sistemas que no están en equilibrio. Muchos sistemas en la naturaleza no están en equilibrio porque están constantemente intercambiando materia y energía con otros sistemas.
Principios fundamentales de la termodinámica
Es importante recordar que estos principios son válidos para sistemas grandes (macroscópicos), pero no se aplican a nivel microscópico (partículas muy pequeñas). La idea del "demonio de Maxwell" es un experimento mental que ayuda a entender los límites del segundo principio de la termodinámica.
Principio cero: ¿Qué es el equilibrio térmico?
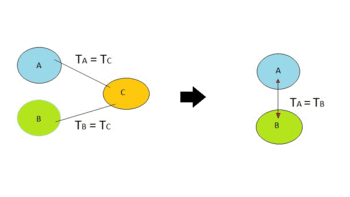
El principio cero de la termodinámica es una ley que describe sistemas en equilibrio térmico. En pocas palabras, dice que si pones un objeto caliente en contacto con uno frío, ambos intercambian calor hasta que sus temperaturas se igualan. Este principio establece que existe una propiedad llamada temperatura empírica (θ), que es la misma para todos los sistemas que están en equilibrio mutuo.
Esta ley es muy importante para construir instrumentos que miden la temperatura, como los termómetros. Permite comparar temperaturas, pero no medirlas con números exactos directamente. Por ejemplo, cuando James Prescott Joule necesitaba comparar sus resultados con los de otro investigador, tuvo que viajar para asegurarse de que sus termómetros daban las mismas lecturas.
El equilibrio termodinámico de un sistema significa que las propiedades que lo definen (como presión, volumen, temperatura) no cambian con el tiempo. El tiempo es importante a nivel microscópico, pero en termodinámica solo nos interesan los estados inicial y final.
También podemos decir que dos sistemas están en equilibrio térmico si, aunque no estén conectados para transferir calor, permanecerían en el mismo estado si se conectaran con una pared que solo permitiera el paso de calor. James Clerk Maxwell lo explicó diciendo: "Todo el calor es del mismo tipo". Este principio es clave para la definición matemática de la temperatura y para que los termómetros funcionen correctamente.
Aunque es fundamental, este principio se formuló después de los otros tres, por eso se le llamó "principio cero".
Otra forma de decirlo es: si dos sistemas están en equilibrio con un tercer sistema por separado, entonces también estarán en equilibrio entre ellos. Si tres o más sistemas están en contacto térmico y en equilibrio, cualquier par de ellos también estará en equilibrio.
Primer principio: La energía no se crea ni se destruye

El primer principio de la termodinámica es una ley que muestra la conservación de la energía en la termodinámica. Dice que si se realiza trabajo sobre un sistema o si este intercambia calor con otro, la energía interna del sistema cambiará. Dicho de otra manera, este principio nos permite entender el calor como la energía que un sistema necesita intercambiar para equilibrar las diferencias entre el trabajo y la energía interna. En palabras sencillas: la energía total del universo se mantiene constante. No se crea ni se destruye, solo se transforma.
La ecuación general de la conservación de la energía es:
Aplicada a la termodinámica, se expresa como:
,
Donde U es la energía interna del sistema (si está aislado), Q es el calor que entra al sistema y W es el trabajo que realiza el sistema. A veces, esta expresión se encuentra como 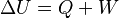 . Ambas son correctas; la diferencia está en cómo se usan los signos (según el convenio IUPAC o el Tradicional).
. Ambas son correctas; la diferencia está en cómo se usan los signos (según el convenio IUPAC o el Tradicional).
Más específicamente, el principio se puede formular así:
En un sistema aislado adiabático (que no intercambia calor con otros sistemas o su entorno, como si estuviera completamente aislado) que cambia de un estado iniciala un estado final
, el trabajo realizado no depende del tipo de trabajo ni del camino seguido.
Formalmente, este principio tiene dos partes:
- El «principio de la accesibilidad adiabática»:
El conjunto de estados de equilibrio a los que puede llegar un sistema termodinámico cerrado es, adiabáticamente, un conjunto simplemente conexo.
El trabajo de la conexión adiabática entre dos estados de equilibrio de un sistema cerrado solo depende de esos dos estados.
Esto significa que el trabajo en un proceso adiabático (sin intercambio de calor) solo depende del estado inicial y final del sistema. Por eso, se puede definir una nueva propiedad del sistema llamada energía interna (U), cuya variación en un proceso adiabático es igual al trabajo intercambiado:
(W del proceso adiabático)
Cuando un sistema cerrado cambia de un estado inicial A a un estado final B, pero no de forma adiabática, la variación de energía debe ser la misma. Sin embargo, el trabajo intercambiado será diferente. La diferencia entre ambos trabajos se debe a la interacción térmica. Entonces, la cantidad de energía térmica intercambiada (Q, o calor) se define como:
o
Donde U es la energía interna, Q es el calor y W es el trabajo. Por convenio, Q es positivo si entra al sistema y negativo si sale. W es positivo si se realiza sobre el sistema y negativo si es realizado por el sistema. Esta definición se relaciona con la ley de la conservación de la energía y nos dice que el calor es una forma de transferencia de energía. Por eso, la ley de la conservación de la energía se usa como uno de los enunciados del primer principio de termodinámica:
La variación de energía de un sistema termodinámico cerrado es igual a la diferencia entre la cantidad de calor y la cantidad de trabajo intercambiados por el sistema con sus alrededores.
En su forma matemática más simple para cualquier sistema cerrado:
Donde:
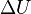 es el cambio en la energía del sistema.
es el cambio en la energía del sistema.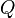 es el calor que el sistema intercambia a través de sus límites.
es el calor que el sistema intercambia a través de sus límites.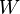 es el trabajo que el sistema intercambia con su entorno.
es el trabajo que el sistema intercambia con su entorno.
Segundo principio: La dirección de los procesos
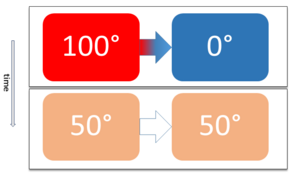
Este principio nos dice en qué dirección ocurren los procesos termodinámicos y por qué no pueden ocurrir al revés. Por ejemplo, una gota de tinta que se dispersa en el agua no puede volver a concentrarse por sí sola. Los procesos reales son irreversibles, lo que significa que solo van en una dirección. Esto se explica por el aumento de una propiedad física llamada entropía (S) en un sistema termodinámico.
El segundo principio también establece que no toda la energía de un tipo puede convertirse completamente en otro tipo sin pérdidas. Por ejemplo, una máquina térmica no puede convertir todo el calor en trabajo. Siempre hay una parte de calor que se "desperdicia" y no se puede usar.
Una consecuencia de esta ley es que el calor siempre fluye de forma natural de los cuerpos más calientes a los más fríos, hasta que alcanzan la misma temperatura (equilibrio térmico).
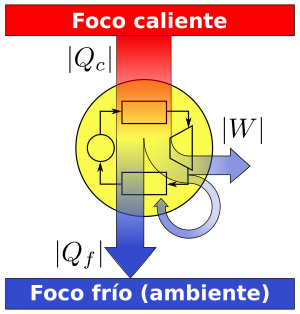
La aplicación más conocida de este principio es en las máquinas térmicas, como los motores. Estas máquinas toman calor de una fuente caliente, realizan trabajo y luego liberan parte de ese calor a una fuente fría. La diferencia entre el calor absorbido y el calor liberado es el trabajo que se obtiene.
Existen varias formas de enunciar este principio, siendo las más famosas las de Clausius y Kelvin.
Enunciado de Clausius
Según Sears, este enunciado dice: "No es posible ningún proceso cuyo único resultado sea extraer calor de un recipiente a una temperatura y que una cantidad igual de calor sea absorbida por un recipiente a una temperatura más alta". En otras palabras, el calor no fluye espontáneamente de un cuerpo frío a uno caliente.
Enunciado de Kelvin-Planck
Este enunciado dice que es imposible construir una máquina térmica que, al funcionar en un ciclo, solo absorba energía de un lugar y realice una cantidad igual de trabajo. Siempre es necesario que la máquina libere parte del calor a un segundo lugar (el "foco frío"). Ese calor liberado no se puede volver a usar para aumentar el calor inicial del sistema. Esto es lo que llamamos entropía.
Refrigeradores y bombas de calor
Un refrigerador es un aparato que quita calor de un lugar frío para pasarlo a un lugar más caliente. Una bomba de calor funciona de manera similar, pero su objetivo principal es calentar un lugar, tomando calor de una fuente fría y liberándolo en un lugar más caliente.
Ambos aparatos necesitan energía (trabajo) para mover el calor de un lugar frío a uno caliente. En estos equipos, los procesos de transferencia de calor ocurren en la dirección opuesta a la de las máquinas térmicas. La relación entre el calor en el lugar caliente (Qh), el calor en el lugar frío (Qc) y el trabajo (W) es: Qh = Qc + W.
Tercer principio: El cero absoluto es inalcanzable
El tercer principio de termodinámica, también conocido como postulado de Nernst, dice que no se puede alcanzar la temperatura de cero absoluto (0 K) en un número limitado de pasos. En resumen, significa:
- Cuando se llega al cero absoluto, cualquier proceso en un sistema físico se detiene.
- Al llegar al cero absoluto, la entropía (el desorden) alcanza su valor más bajo.
Algunas fuentes se refieren incorrectamente al postulado de Nernst como "la tercera de las leyes de la termodinámica". Es importante saber que no es una idea que la termodinámica clásica exija, por lo que no es apropiado llamarla "ley". Incluso es un poco inconsistente con la física estadística clásica y necesita de la física cuántica para entenderse bien. La mayor parte de la termodinámica no necesita este postulado. El postulado de Nernst, propuesto por Walther Nernst, afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un número finito de procesos físicos. También se puede decir que, a medida que un sistema se acerca al cero absoluto, su entropía tiende a un valor constante específico. La entropía de los sólidos cristalinos puros puede considerarse cero a temperaturas iguales al cero absoluto.
El 14 de marzo de 2017, los físicos Lluís Masanes y Jonathan Oppenheim, del Departamento de Física y Astronomía del University College de Londres, publicaron en la revista Nature una demostración matemática de este principio.
¿Qué es un sistema termodinámico?
Un sistema es una parte de la materia que estamos estudiando, limitada por paredes reales o imaginarias.
- Si no entra ni sale materia del sistema, se llama sistema cerrado. Si además no hay intercambio de energía, se llama sistema aislado. En la naturaleza, es casi imposible encontrar un sistema perfectamente aislado, pero podemos hacer aproximaciones.
- Un sistema abierto es aquel del que entra y/o sale materia.
Algunos ejemplos:
- Un coche es un sistema abierto: le pones combustible y libera gases y calor.
- Un reloj de cuerda es un sistema cerrado: no le metes ni le sacas materia, solo necesita energía para funcionar.
- Un termo con comida caliente es una buena aproximación de un sistema aislado: el envase no deja que la materia entre o salga, y trata de evitar que el calor se escape. El universo entero se considera un sistema aislado, donde el cambio total de energía es cero (
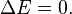 ).
).
¿Qué es el medio externo?
El medio externo o ambiente es todo lo que está fuera del sistema que estudiamos, pero que puede afectarlo. Por ejemplo, si calientas una taza de agua con un mechero, el sistema es la taza y el agua. El medio externo sería el mechero, el aire, etc.
Equilibrio térmico
El equilibrio térmico es el estado en el que las temperaturas de dos cuerpos se igualan. Si al principio tenían temperaturas diferentes, una vez que se igualan, deja de haber transferencia de calor entre ellos. Así, el sistema termodinámico alcanza el equilibrio térmico.
El equilibrio térmico se produce cuando dos cuerpos con temperaturas diferentes se tocan. El cuerpo más caliente le pasa energía térmica (calor) al más frío, hasta que ambos tienen la misma temperatura.
Variables termodinámicas
Las variables que describen el estado interno de un sistema se llaman variables termodinámicas. Las más importantes son:
- La masa
- El volumen
- La densidad
- La presión
- La temperatura
Las propiedades de estas variables se clasifican en dos tipos:
- Propiedades intensivas: No dependen de la cantidad de sustancia o del tamaño del sistema. Por ejemplo, la temperatura o la densidad. Si divides un sistema, estas propiedades no cambian.
- Propiedades extensivas: Sí dependen de la cantidad de sustancia del sistema. Por ejemplo, la masa, el volumen o la energía. Si divides un sistema, el valor de estas propiedades para el sistema completo es la suma de los valores de sus partes.
Un ejemplo: si divides la masa entre el volumen, obtienes la densidad, que es una propiedad intensiva.
Estado de un sistema
Un sistema que se puede describir con variables termodinámicas se llama sistema termodinámico. La situación en la que se encuentra, definida por esas variables, se llama estado del sistema.
Contacto térmico
Se dice que dos sistemas están en contacto térmico cuando pueden intercambiar calor entre sí.
Procesos termodinámicos
Un sistema pasa por un proceso termodinámico cuando al menos una de sus variables termodinámicas cambia. Los procesos más importantes son:
- Procesos isotérmicos: La temperatura no cambia.
- Procesos isobáricos: La presión no cambia.
- Procesos isocóricos: El volumen permanece constante.
- Procesos adiabáticos: No hay transferencia de calor.
- Procesos diatérmicos: Permiten que el calor pase fácilmente.
- Procesos isoentrópicos: Son procesos adiabáticos y reversibles, donde la entropía no cambia.
Por ejemplo, si pones agua caliente y cubos de hielo en un termo, ocurre un proceso adiabático. El agua se enfría y el hielo se calienta y se derrite hasta que ambos alcanzan la misma temperatura. Pero como el termo está aislado, no hay intercambio de calor con el exterior.
Rendimiento termodinámico o eficiencia
Un concepto clave en la ingeniería térmica es el rendimiento. El rendimiento de una máquina térmica se calcula como:
Donde 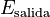 es la energía que la máquina produce (por ejemplo, trabajo) y
es la energía que la máquina produce (por ejemplo, trabajo) y 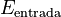 es la energía que se le suministra (por ejemplo, calor).
es la energía que se le suministra (por ejemplo, calor).
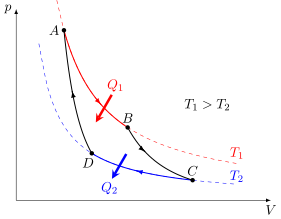
Teorema de Carnot
En 1824, Nicolas Léonard Sadi Carnot demostró que el rendimiento máximo posible de una máquina térmica (llamadas máquinas de Carnot) que funciona entre dos "termostatos" (fuentes de calor con temperatura constante) solo depende de las temperaturas de esas fuentes. Por ejemplo, el rendimiento de un motor térmico de Carnot se calcula con:
Donde 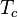 es la temperatura de la fuente caliente y
es la temperatura de la fuente caliente y 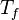 es la temperatura de la fuente fría, ambas medidas en Kelvin.
es la temperatura de la fuente fría, ambas medidas en Kelvin.
Este rendimiento máximo es ideal. Cualquier máquina térmica real tendrá un rendimiento menor que una máquina de Carnot que funcione entre las mismas temperaturas.
Instrumentos termodinámicos
Hay dos tipos principales de instrumentos termodinámicos: los medidores y los depósitos.
Un medidor termodinámico es cualquier aparato que mide una propiedad de un sistema termodinámico. A veces, la propiedad se define a partir de cómo funciona un instrumento ideal. Por ejemplo, el principio cero dice que si dos cuerpos están en equilibrio térmico con un tercero, también lo están entre sí. Esto, como señaló James Clerk Maxwell en 1872, significa que podemos medir la temperatura. Un termómetro idealizado, por ejemplo, podría ser una muestra de gas ideal a presión constante. Su volumen cambiaría con la temperatura, sirviendo como indicador. Un barómetro mide la presión, y un calorímetro mide la energía interna de un sistema.
Un depósito termodinámico es un sistema tan grande que sus propiedades no cambian mucho cuando entra en contacto con el sistema que nos interesa. Cuando el depósito se conecta al sistema, el sistema alcanza el equilibrio con el depósito. Por ejemplo, la atmósfera terrestre a menudo actúa como un depósito de presión, y el océano puede ser un depósito de temperatura para enfriar centrales eléctricas.
Variables conjugadas
El concepto central de la termodinámica es la energía, que es la capacidad de realizar trabajo. Según el Primer Principio, la energía total de un sistema y su entorno se mantiene. La energía puede entrar a un sistema por calentamiento, compresión o añadiendo materia, y salir por enfriamiento, expansión o quitando materia. En mecánica, por ejemplo, la transferencia de energía es el producto de una fuerza aplicada y el desplazamiento resultante.
Las variables conjugadas son pares de conceptos termodinámicos. La primera es como una "fuerza" aplicada a un sistema termodinámico, la segunda es como el "desplazamiento" que resulta, y el producto de ambas es la cantidad de energía transferida. Algunos pares comunes son:
- Presión-volumen (relacionados con la mecánica).
- Temperatura-entropía (relacionados con el calor).
- Potencial químico-número de partículas (relacionados con la materia).
Campos de aplicación
- Dinámica de la atmósfera
- Termodinámica biológica
- Termodinámica de los agujeros negros
- Termodinámica química
- Termodinámica clásica
- Termodinámica del equilibrio
- Ecología industrial (re: Exergía)
- Termodinámica de máxima entropía
- Termodinámica del no-equilibrio
- Filosofía de la física térmica y estadística
- Psicrometría
- Termodinámica cuántica
- Termodinámica estadística
- Termoeconomía
Diagramas termodinámicos
- Diagrama PVT
- Diagrama de fase
- Diagrama p-v
- Diagrama temperatura-entropía
Véase también
 En inglés: Thermodynamics Facts for Kids
En inglés: Thermodynamics Facts for Kids
- Ludwig Boltzmann
- Calor y temperatura (continuación del estudio de la termodinámica)
- Caos
- Constante de Boltzmann
- Energía
- Entalpía
- Entropía
- Exergía
- Neguentropía
- Sistémica
- Termoquímica
- Transmisión de calor
- Fluctuación cuántica
Galería de imágenes
-
Transferencia de calor por convección.
-
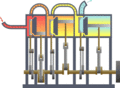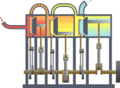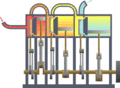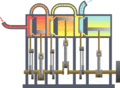
Máquina térmica típica donde se puede observar la entrada desde una fuente de calor (caldera) a la izquierda y la salida a un disipador de calor (condensador) a la derecha. El trabajo se extrae en este caso mediante una serie de pistones.