Primer principio de la termodinámica para niños

El primer principio de la termodinámica es una regla muy importante en la física que nos ayuda a entender cómo se comporta la energía. Imagina que la energía es como una cantidad total que siempre existe en el universo. Este principio dice que la energía no se crea ni se destruye, ¡solo se transforma! Es como si tuvieras una cantidad fija de plastilina: puedes cambiar su forma, pero la cantidad total de plastilina sigue siendo la misma.
En el mundo de la termodinámica, que estudia el calor y la energía, este principio nos dice que si un sistema (como una máquina o un objeto) recibe trabajo o intercambia calor con su entorno, su energía interna cambiará. La energía interna es la energía que está guardada dentro del sistema.
Podemos resumir esto con una ecuación sencilla:
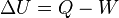
Aquí:
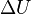 (se lee "delta U") es el cambio en la energía interna del sistema.
(se lee "delta U") es el cambio en la energía interna del sistema.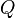 es la cantidad de calor que entra o sale del sistema. Si entra, es positivo; si sale, es negativo.
es la cantidad de calor que entra o sale del sistema. Si entra, es positivo; si sale, es negativo.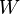 es el trabajo que el sistema hace o que se hace sobre él. Si el sistema hace trabajo, es negativo; si se hace trabajo sobre el sistema, es positivo.
es el trabajo que el sistema hace o que se hace sobre él. Si el sistema hace trabajo, es negativo; si se hace trabajo sobre el sistema, es positivo.
Esta ecuación nos muestra cómo el calor y el trabajo se relacionan con la energía interna de un sistema.
Contenido
¿Qué es el Primer Principio de la Termodinámica?
El primer principio de la termodinámica es una forma de entender la conservación de la energía. Nos dice que la energía total en un sistema aislado (que no intercambia nada con el exterior) siempre se mantiene igual. Si un sistema cambia de un estado a otro, el trabajo que se realiza sobre él no depende de cómo se hizo ese trabajo, solo de los estados inicial y final.
Esto nos ayuda a definir la energía interna (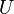 ) de un sistema. Es una propiedad que solo depende del estado actual del sistema, no de cómo llegó a ese estado.
) de un sistema. Es una propiedad que solo depende del estado actual del sistema, no de cómo llegó a ese estado.
Cuando un sistema intercambia calor (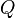 ) y trabajo (
) y trabajo (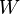 ) con su entorno, la suma de estas transferencias de energía es igual al cambio en su energía interna. Es decir, la energía que entra o sale del sistema como calor o trabajo se convierte en energía interna.
) con su entorno, la suma de estas transferencias de energía es igual al cambio en su energía interna. Es decir, la energía que entra o sale del sistema como calor o trabajo se convierte en energía interna.
Historia del Primer Principio
La idea de la conservación de la energía ha sido estudiada por muchos científicos a lo largo de la historia.
El primer principio de la termodinámica fue propuesto inicialmente por Nicolas Léonard Sadi Carnot en 1824. Él escribió sobre cómo funcionan las máquinas de vapor y cómo se produce el movimiento a partir del calor. Sus ideas fueron muy importantes, aunque no fueron completamente entendidas en su momento.
Más tarde, en la década de 1840, varios físicos como Joule, Helmholtz y Meyer trabajaron en esta ley. Ellos demostraron con experimentos que el calor y el trabajo son diferentes formas de energía y que se pueden transformar una en la otra.
Finalmente, Rudolf Clausius en 1850 y Lord Kelvin en 1851 fueron quienes formularon este principio de manera matemática y formal. Clausius, por ejemplo, dijo que en un proceso donde un sistema cerrado cambia, el aumento de su energía interna es igual a la diferencia entre el calor que recibe y el trabajo que realiza.
Al principio, los científicos veían el calor como algo "primitivo" o básico. Luego, con el tiempo, se entendió que el calor es una forma de transferencia de energía, al igual que el trabajo. Esta nueva forma de ver las cosas, llamada el "enfoque mecánico", ayudó a entender mejor cómo la energía se mueve y se transforma.
¿Cómo se describe la energía en el Primer Principio?
La forma más común de transferir energía en la física es a través del trabajo. El trabajo puede ser mecánico (como empujar algo), eléctrico (como la electricidad que enciende una bombilla) o de otros tipos. Lo importante es que el trabajo transfiere energía. La cantidad de energía transferida por trabajo depende de cómo se realiza el proceso, no solo del inicio y el final.
El calor es otra forma de transferir energía, pero esta es especial de la termodinámica. El calor se transfiere solo cuando hay una diferencia de temperatura entre los sistemas. Por ejemplo, si pones una cuchara fría en una sopa caliente, el calor se transferirá de la sopa a la cuchara. Al igual que el trabajo, la cantidad de calor transferida también depende del proceso.
Lo que los experimentos nos muestran es que, no importa cómo un sistema cambie de un estado a otro, la suma de la energía transferida como trabajo y la energía transferida como calor siempre es la misma. Esta suma se usa para cambiar la energía interna del sistema. Esto significa que el cambio en la energía interna de un sistema no depende de cómo se hizo el cambio, ¡solo de dónde empezó y dónde terminó!
En resumen, el primer principio de la termodinámica conecta el trabajo y el calor (que dependen del proceso) con la energía interna (que no depende del proceso).
Aplicaciones del Primer Principio
El primer principio de la termodinámica se aplica a diferentes tipos de sistemas:
Sistemas cerrados
Un sistema cerrado es como una botella bien tapada: no puede entrar ni salir masa de él. Sin embargo, sí puede intercambiar calor y trabajo con lo que lo rodea. Por ejemplo, una olla a presión cerrada es un sistema cerrado. Puede calentarse (intercambio de calor) y el vapor dentro puede empujar una válvula (hacer trabajo).
La ecuación para un sistema cerrado es:
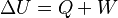
Donde 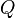 es el calor total y
es el calor total y 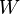 es el trabajo total (mecánico, eléctrico, etc.).
es el trabajo total (mecánico, eléctrico, etc.).
Sistemas abiertos
Un sistema abierto es como una tubería por la que fluye agua: puede entrar y salir masa, además de intercambiar calor y trabajo. Por ejemplo, el motor de un coche es un sistema abierto porque entra combustible y aire, y salen gases de escape.
La ecuación para un sistema abierto es más compleja porque hay que considerar la energía que entra y sale con la masa. Sin embargo, la idea principal sigue siendo la misma: la energía total se conserva.
Sistemas abiertos en estado estacionario
Un sistema en estado estacionario es un tipo especial de sistema abierto donde las cosas no cambian con el tiempo. Es decir, la cantidad de masa y energía que entra es igual a la que sale, por lo que el sistema se mantiene constante. Por ejemplo, una central eléctrica que funciona de manera continua está en estado estacionario. En este caso, el cambio de energía interna del sistema es cero.
Sistema aislado
Un sistema aislado es como un termo perfecto: no intercambia ni masa ni energía con el exterior. Es el sistema más simple para entender la conservación de la energía, ya que su energía interna siempre se mantiene constante.
Galería de imágenes
Véase también
 En inglés: First law of thermodynamics Facts for Kids
En inglés: First law of thermodynamics Facts for Kids


