Sistema termodinámico para niños
Un sistema termodinámico es como una parte del universo que elegimos para estudiar. Imagina que quieres entender cómo funciona una máquina de vapor o cómo se calienta el agua en una olla. Para hacerlo, "aislas" esa parte específica del resto del mundo.
Este "aislamiento" puede ser real, como cuando los científicos usan un recipiente especial en un laboratorio. O puede ser imaginario, si solo estamos pensando en cómo se comportaría algo en teoría.
En pocas palabras, un sistema termodinámico es un grupo de materia (como agua o aire) o energía (como la luz), que está dentro de unos límites. Estos límites, que llamamos "paredes", lo separan de lo que lo rodea, que es el "entorno". El entorno puede ser cualquier otra cosa que no sea parte de nuestro sistema. A veces, estas paredes pueden ser solo una idea para ayudarnos a estudiar una parte de un sistema más grande.
El "estado" de un sistema termodinámico se describe usando diferentes características, como la temperatura, la presión o el volumen. Si conocemos estas características, sabemos cómo es el sistema en ese momento.
Contenido
Historia de los Sistemas Termodinámicos
¿Quién propuso la idea de un sistema termodinámico?
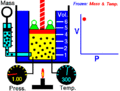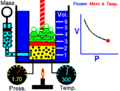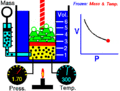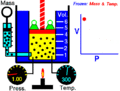
La idea de un sistema termodinámico fue propuesta por primera vez por el físico francés Nicolas Léonard Sadi Carnot en 1824. Él estaba estudiando cómo las máquinas de vapor producían movimiento a partir del calor. Carnot se fijó en el vapor de agua dentro de la máquina y cómo este "cuerpo de trabajo" interactuaba con una fuente de calor (como una caldera), una fuente fría (como agua fría) y un pistón. Quería saber cuánto trabajo podía hacer este sistema al recibir calor.
Más tarde, en 1850, el físico alemán Rudolf Clausius amplió esta idea. Él incluyó el concepto de "entorno" y empezó a llamar al sistema un "cuerpo de trabajo". Clausius explicó que cuando el volumen de este cuerpo de trabajo cambiaba, se realizaba un trabajo. Por ejemplo, si el gas se expandía, empujaba algo; si se comprimía, algo lo empujaba a él.
Tipos de Sistemas Termodinámicos
Los sistemas termodinámicos se clasifican según cómo interactúan con su entorno. Hay tres tipos principales:
- Sistema aislado: Este sistema no intercambia ni materia ni energía con su entorno. Es como si estuviera completamente sellado y sin contacto con el exterior. Un ejemplo sería un termo muy, muy bueno que mantuviera la temperatura de una bebida para siempre y que no dejara escapar nada. En la realidad, es difícil encontrar un sistema perfectamente aislado.
- Sistema cerrado: Este sistema puede intercambiar energía con el exterior, pero no materia. Piensa en una olla a presión: el calor puede entrar o salir, pero la comida y el vapor se quedan dentro. Otro ejemplo es una lata de sardinas cerrada.
- Sistema abierto: Este es el tipo más común y lo vemos en la vida diaria. Un sistema abierto puede intercambiar tanto materia como energía con su entorno. Un vehículo motorizado es un buen ejemplo: necesita combustible (materia), emite gases de escape (materia) y también produce calor y movimiento (energía).
¿Cómo se clasifican los sistemas por su composición?
También podemos clasificar los sistemas según si son uniformes o no:
- Sistemas homogéneos: Son aquellos cuyas propiedades son las mismas en cualquier parte del sistema. Por ejemplo, un vaso de agua pura es homogéneo, o una mezcla de agua y azúcar bien disuelta.
- Sistemas heterogéneos: Son aquellos cuyas propiedades no son uniformes. Por ejemplo, un vaso con agua y hielo, donde el agua y el hielo son diferentes "fases".
En termodinámica, los sistemas que se estudian suelen ser sencillos. Su estado se puede describir con unas pocas características, como la presión, la temperatura y el volumen. Estas características están relacionadas entre sí.
Sistemas en Equilibrio
¿Qué significa que un sistema esté en equilibrio?
Cuando un sistema está en equilibrio termodinámico, sus propiedades (como la temperatura o la presión) no cambian con el tiempo. Son mucho más fáciles de estudiar que los sistemas que no están en equilibrio.
Imagina un sistema aislado: con el tiempo, las cosas dentro de él tienden a estabilizarse. Las temperaturas y presiones se igualan, y la materia se organiza en partes uniformes. Cuando todos los cambios posibles dentro del sistema se han completado, decimos que está en equilibrio.
Para que un proceso sea "reversible" (que pueda ir hacia adelante y hacia atrás sin dejar rastro), cada paso debe estar en equilibrio. Esto es una idea perfecta que no se logra en la vida real, pero podemos acercarnos si los cambios son muy, muy lentos.
Paredes Termodinámicas
Las paredes termodinámicas son los límites que separan un sistema de su entorno. Nos dicen cómo el sistema interactúa con el resto del universo.
Tipos de Paredes: Restrictivas
Estas paredes limitan lo que puede pasar:
- Adiabáticas: No permiten el paso de energía térmica (calor). Piensa en una pared que aísla completamente del frío o del calor.
- Rígidas: No pueden moverse, lo que significa que el volumen del sistema no puede cambiar.
- Impermeables: No permiten el paso de materia.
Tipos de Paredes: Permisivas
Estas paredes permiten el paso de algo:
- Diatérmicas: Permiten el paso de energía térmica (calor).
- Móviles: Pueden moverse, permitiendo que el volumen del sistema cambie.
- Permeables: Permiten el paso de materia.
Galería de imágenes
Véase también
 En inglés: Thermodynamic system Facts for Kids
En inglés: Thermodynamic system Facts for Kids