Energía interna para niños
La energía interna (representada con la letra U) de un objeto es la energía que está guardada dentro de él. Imagina que un objeto está hecho de muchísimas partículas diminutas, como átomos y moléculas. La energía interna es la suma de la energía de todas esas partículas.
Esta energía se divide en dos tipos principales:
- Energía cinética interna: Es la energía del movimiento de las partículas dentro del objeto. Las partículas pueden moverse de diferentes maneras: vibrar en su lugar, girar o trasladarse de un lado a otro.
- Energía potencial interna: Es la energía que tienen las partículas debido a las fuerzas que actúan entre ellas. Piensa en cómo se atraen o repelen, como pequeños imanes.
Es importante saber que la energía interna no incluye la energía que tiene un objeto por moverse completo (como un coche en movimiento) o por su posición (como una pelota en lo alto de una colina). Se trata solo de la energía que está "dentro" del objeto.
Contenido
¿De qué está hecha la energía interna?
Si pensamos en los átomos y moléculas que forman un objeto, la energía interna es la suma de:
- La energía de movimiento (cinética) de esas moléculas o átomos. Esto incluye su movimiento de traslación (desplazarse), rotación (girar) y vibración (moverse como un resorte).
- La energía potencial que tienen debido a las fuerzas entre las moléculas y dentro de ellas (la energía de los enlaces químicos).
Por ejemplo:
- En un gas simple (como el helio), la energía interna es principalmente la energía de movimiento de sus átomos.
- En un gas más complejo (como el oxígeno), también hay que considerar la energía de vibración y rotación de sus moléculas.
- En un líquido o un sólido, además de los movimientos, es muy importante la energía potencial de las interacciones entre las moléculas, ya que están muy cerca unas de otras.
Cambios en la energía interna
En la termodinámica, que es la ciencia que estudia la energía y el calor, sabemos que la energía interna de un sistema puede cambiar. Si un sistema está "cerrado" (es decir, no entra ni sale materia), su energía interna puede variar si le añadimos o le quitamos calor, o si realizamos un trabajo sobre él.
La fórmula para esto es: 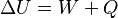 Donde:
Donde:
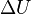 es el cambio en la energía interna.
es el cambio en la energía interna.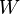 es el trabajo que se hace sobre el sistema (o que el sistema hace).
es el trabajo que se hace sobre el sistema (o que el sistema hace).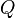 es el calor que se transfiere al sistema (o que el sistema libera).
es el calor que se transfiere al sistema (o que el sistema libera).
Lo interesante es que el cambio en la energía interna solo depende del estado inicial y final del sistema, no de cómo se llegó a ese estado. Es como subir una montaña: el cambio de altura solo depende de dónde empezaste y dónde terminaste, no del camino que tomaste.
¿Cómo se mide la energía interna?
La energía interna de un objeto no se puede medir directamente en su totalidad. Lo que sí podemos medir son los cambios en la energía interna. Estos cambios se calculan sumando las energías que se transfieren al sistema.
Desde un punto de vista muy pequeño (microscópico), la energía interna se puede dividir en energía potencial microscópica y energía cinética microscópica. La energía cinética microscópica es la suma de los movimientos de todas las partículas del sistema. La energía potencial microscópica viene de los enlaces químicos, las fuerzas entre partículas y la deformación de los materiales.
La energía interna es una propiedad extensiva, lo que significa que depende del tamaño del sistema o de la cantidad de sustancia que contiene. Cuanta más materia haya, más energía interna tendrá.
A cualquier temperatura por encima del cero absoluto (la temperatura más fría posible), la energía potencial y la energía cinética de las partículas se están transformando constantemente una en otra. Sin embargo, la suma total de la energía interna se mantiene constante en un sistema aislado. Incluso en el cero absoluto, las partículas tienen una pequeña cantidad de energía de movimiento llamada "energía del punto cero", según la mecánica cuántica.
La parte de la energía cinética microscópica de la energía interna es lo que da lugar a la temperatura de un sistema. Cuanto más rápido se muevan las partículas, mayor será la temperatura.
Variaciones de la energía interna
Cuando la temperatura de un sistema aumenta, su energía interna también lo hace. Esto se ve en el aumento de la energía térmica del sistema.
Variación sin cambio de estado
Si la materia no cambia de estado (por ejemplo, el agua sigue siendo líquida), el cambio en la energía interna se llama calor sensible. Se puede calcular con la siguiente fórmula:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): Q = C_e \cdot m \cdot \Delta T
Donde:
- Q es la cantidad de energía o calor transferido (en Julios, J).
- Ce es el calor específico de la materia (cuánta energía necesita para subir su temperatura, en J/(kg·K)).
- m es la masa de la materia (en kilogramos, kg).
 es el cambio de temperatura (temperatura final menos temperatura inicial, en Kelvin, K).
es el cambio de temperatura (temperatura final menos temperatura inicial, en Kelvin, K).
Ejemplo de calor sensible
Imagina que quieres calcular cuánta energía necesitas para calentar 1 gramo de agua de 14 °C a 15 °C. Sabemos que el calor específico del agua es aproximadamente 1 caloría por gramo y grado Celsius (o 4.184 J/(g·°C)).
Usando la fórmula: Q = 1 [cal/(g·°C)] · 1 [g] · (15 - 14) [°C] = 1 [caloría]
Esto significa que necesitas 1 caloría de energía para subir la temperatura de 1 gramo de agua en 1 grado Celsius.
Variación con cambio de estado
Si la materia cambia de estado (por ejemplo, el agua se convierte en vapor o hielo), se habla de variación de la energía interna latente. Esta energía se usa para romper o formar los enlaces entre las partículas, no para cambiar la temperatura.
Se calcula con: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): Q = C_{ce} \cdot m\!
Donde:
- Q es la energía transferida.
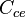 es el coeficiente de cambio de estado (energía necesaria para que una unidad de masa cambie de estado, en J/kg).
es el coeficiente de cambio de estado (energía necesaria para que una unidad de masa cambie de estado, en J/kg).- m es la masa.
Variación nuclear
En procesos como la fisión nuclear (cuando un átomo grande se divide) o la fusión nuclear (cuando átomos pequeños se unen), se libera o absorbe una cantidad enorme de energía. A esta se le llama energía interna nuclear.
Galería de imágenes
Véase también
 En inglés: Internal energy Facts for Kids
En inglés: Internal energy Facts for Kids



