Acidificación del océano para niños
La acidificación del océano es un proceso en el que el agua de los océanos se vuelve menos alcalina, es decir, su nivel de pH disminuye. Esto ocurre principalmente porque los océanos absorben una gran cantidad de dióxido de carbono (CO2) de la atmósfera.
Desde la Revolución Industrial, las actividades humanas han liberado mucho más CO2 a la atmósfera. Esto se debe a la quema de combustibles fósiles, la deforestación (tala de árboles) y la fabricación de productos como el cemento. Aproximadamente un tercio de este CO2 extra ha sido absorbido por los océanos, lo que los convierte en los principales "sumideros de carbono" del planeta.
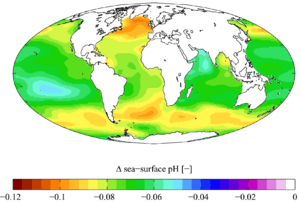
Cuando el CO2 se disuelve en el agua del mar, provoca cambios químicos que hacen que el agua sea menos alcalina. Un pequeño cambio en el pH del agua puede tener consecuencias importantes para la vida marina, especialmente para los arrecifes de coral, que son muy sensibles a estos cambios. Se calcula que entre 1751 y 1994, el pH de la superficie del océano bajó de 8.179 a 8.104. Las predicciones indican que para el año 2100, el pH podría bajar aún más.
Contenido
¿Por qué se acidifica el océano?
El agua de mar y el aire están siempre en contacto, intercambiando CO2. Cuando el CO2 entra en el agua, reacciona con ella y forma diferentes sustancias químicas. Una de estas reacciones libera iones de hidrógeno (H+), que son los que hacen que el agua sea menos alcalina.
La reacción es así: CO2 + H2O ⇌ H2CO3 ⇌ HCO3− + H+ ⇌ CO32− + 2H+
Cuanto más CO2 hay en la atmósfera, más se disuelve en el océano y más iones H+ se liberan, lo que reduce el pH del agua. Este proceso actúa como un "amortiguador" natural que ayuda a controlar los cambios en la concentración de CO2 causados por factores como los volcanes o las actividades humanas.
La velocidad a la que el océano se está volviendo menos alcalino es al menos 100 veces más rápida que en los últimos cientos de miles de años. Esto puede afectar a muchos animales marinos como corales, estrellas de mar, ostras, cangrejos, gambas, mejillones, langostas, cocolitóforos (un tipo de fitoplancton), pterópodos (caracoles marinos) y foraminíferas (otro tipo de plancton).
El ciclo del carbono
En el ciclo natural del carbono, el dióxido de carbono (CO2) se mueve de forma equilibrada entre los océanos, las plantas de la Tierra y la atmósfera. Sin embargo, las actividades humanas, como los cambios en el uso del suelo, la quema de combustibles fósiles y la producción de cemento, han añadido mucho más CO2 a la atmósfera.
Parte de este CO2 extra se queda en la atmósfera, parte es absorbida por las plantas terrestres y otra parte es absorbida por los océanos. Cuando el CO2 se disuelve en el agua, reacciona y forma diferentes compuestos químicos, como el ácido carbónico, el bicarbonato y el carbonato. La cantidad de cada uno de estos compuestos depende de factores como la temperatura del agua de mar.
¿Cómo ha cambiado el pH?
| Tiempo | pH | Cambio en el pH | Fuente |
|---|---|---|---|
| Antes de la industria (1700s) | 8,179 | 0.000 | análisis de campo |
| Recientemente (1990s) | 8,104 | -0,075 | campo |
| 2050 (si el CO2 se duplica) | 7.949 | -0,230 | modelo |
| 2100 (según un modelo) | 7,824 | -0,355 | modelo |
El CO2 disuelto en el agua aumenta la concentración de iones de hidrógeno, lo que hace que el pH del océano baje. Aunque el océano se está volviendo menos alcalino, su pH sigue siendo superior a 7 (que es el pH del agua neutra). Esto significa que el océano no se vuelve ácido como el vinagre, sino que se hace menos alcalino de lo que era antes.
Posibles efectos en la vida marina
Aunque los océanos absorben CO2 y esto ayuda a reducir los efectos del cambio climático en la atmósfera, la disminución del pH tiene consecuencias negativas para los organismos que construyen sus esqueletos o conchas con carbonato cálcico. Estos organismos incluyen cocolitofóridos, corales, foraminíferos, equinodermos, crustáceos y moluscos.
Normalmente, el carbonato cálcico es estable en las aguas superficiales. Pero a medida que el pH baja, la concentración de iones carbonato disminuye. Cuando hay muy poco carbonato, las estructuras hechas de carbonato cálcico se vuelven vulnerables y pueden disolverse. Investigaciones han demostrado que los corales, las algas cocolitofóridas, los foraminíferos y los mariscos tienen más dificultades para construir sus estructuras y estas se disuelven más fácilmente cuando están expuestos a altos niveles de CO2.
Las consecuencias exactas de estos cambios en la vida marina aún no se conocen por completo, pero es claro que las especies que dependen del carbonato cálcico se verán afectadas. Además de los efectos en la formación de conchas y esqueletos, los organismos pueden sufrir otros problemas directos o indirectos. Por ejemplo, la acidificación puede afectar su fisiología (cómo funcionan sus cuerpos) y su capacidad de reproducción, o impactar negativamente sus fuentes de alimento.
Véase también
 En inglés: Ocean acidification Facts for Kids
En inglés: Ocean acidification Facts for Kids
- pH del agua de mar
- Bomba de solubilidad
- Blanqueo de coral
Galería de imágenes
-
Cambio en el pH de la superficie marina causado por el CO2 antropogénico entre los años 1700 y los 1990.