Cloruro de sodio para niños
Datos para niños
Cloruro de sodio |
||
|---|---|---|
 Cristal de cloruro de sodio.
|
||
 |
||
| Nombre IUPAC | ||
| Cloruro de sodio. | ||
| General | ||
| Otros nombres | Cloruro sódico Sal común Sal de cocina Sodio cloruro Nombre mineral: Halita |
|
| Fórmula molecular | NaCl | |
| Identificadores | ||
| Número CAS | 7647-14-5 | |
| Número RTECS | VZ4725000 | |
| ChEBI | 26710 | |
| ChEMBL | CHEMBL1200574 | |
| ChemSpider | 5044 | |
| DrugBank | DB09153 | |
| PubChem | 5234 | |
| UNII | 451W47IQ8X | |
| KEGG | D02056 C13563, D02056 | |
|
InChI
InChI=InChI=1S/ClH.Na/h1H;/q;+1/p-1
Key: FAPWRFPIFSIZLT-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Apariencia | Incoloro; aunque parece blanco si son cristales finos o pulverizados. | |
| Densidad | 2160 kg/m³; 2,16 g/cm³ | |
| Masa molar | 58,443 g/mol | |
| Punto de fusión | 1074 K (801 °C) | |
| Punto de ebullición | 1738 K (1465 °C) | |
| Estructura cristalina | f.c.c. | |
| Índice de refracción (nD) | 1,544202 | |
| Propiedades químicas | ||
| Solubilidad en agua | 359 g/L en agua | |
| Producto de solubilidad | 37,79 mol² | |
| Termoquímica | ||
| ΔfH0gas | -181,42 kJ/mol | |
| ΔfH0líquido | -385,92 kJ/mol | |
| ΔfH0sólido | -411,12 kJ/mol | |
| S0gas, 1 bar | 229,79 J·mol–1·K | |
| S0líquido, 1 bar | 95,06 J·mol–1·K–1 | |
| S0sólido | 72,11 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
0
0
|
|
| Riesgos | ||
| Ingestión | Peligroso en grandes cantidades; su uso a largo plazo en cantidades normales puede traer problemas en los riñones; Su consumo excesivo también está relacionado con la hipertensión arterial. | |
| Inhalación | Puede producir irritación en altas cantidades. | |
| Piel | Puede producir resequedad. | |
| Ojos | Puede producir irritación y molestia. | |
| Compuestos relacionados | ||
| Cloruros alcalinos | Cloruro de potasio, cloruro de litio, cloruro de cesio | |
| Haluros de sodio | Bromuro sódico, fluoruro sódico, ioduro sódico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El cloruro de sodio, también conocido como sal común o sal de mesa, es un compuesto químico con la fórmula NaCl. En la naturaleza, se encuentra como un mineral llamado halita.
El cloruro de sodio es una de las sales que hacen que el océano sea salado. También está presente en los líquidos de nuestro cuerpo. Es el ingrediente principal de la sal común, que usamos para dar sabor a la comida y para conservarla.
Cien gramos de sal contienen aproximadamente 39.34 gramos de sodio y 60.66 gramos de cloro. Además de su uso en la cocina, la sal se utiliza en muchas industrias. Es una fuente importante de sodio y cloro para fabricar otros productos químicos. También se usa para derretir el hielo en las carreteras cuando hace mucho frío.
Hace mucho tiempo, la sal era tan valiosa que se usaba como moneda. En la antigua Roma, a los soldados se les pagaba con sal, de ahí viene la palabra "salario".
Contenido
¿Qué es el cloruro de sodio?
El cloruro de sodio es un compuesto iónico. Esto significa que está formado por dos partes con cargas eléctricas opuestas: un catión de sodio (Na+) y un anión de cloro (Cl-).
¿Cómo se separa el cloruro de sodio?
Una forma de separar los componentes de la sal es mediante la electrólisis. Este proceso usa electricidad para dividir el cloruro de sodio en sus elementos.
Si se aplica electricidad a una solución de sal (llamada salmuera), se producen diferentes sustancias. En un lado, se forma gas dicloro (Cl2). En el otro, se producen hidróxido de sodio (NaOH) y gas dihidrógeno (H2).
- electrólisis: 2 NaCl(aq) → 2 NaOH(aq) + Cl2(gas) + H2(gas)
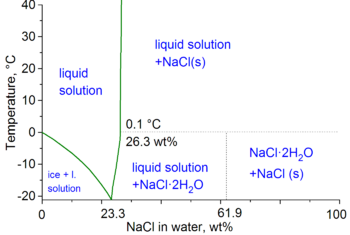
La sal también puede cambiar algunas propiedades de las soluciones. Por ejemplo, puede hacer que el agua hierva a una temperatura más alta o se congele a una temperatura más baja. Esto depende de la cantidad de sal que se disuelva.
¿Cómo se ve la sal a nivel microscópico?
Cuando la sal está en estado sólido, sus átomos se organizan de una forma muy ordenada. Forman una estructura cúbica, como pequeños cubos. Cada ion de sodio está rodeado por seis iones de cloro, y viceversa.
Esta estructura es muy común en muchos otros compuestos y se conoce como la estructura cristalina de la halita o sal de roca.
¿De dónde viene la sal?
El cloruro de sodio se produce en grandes cantidades. Se obtiene principalmente de dos maneras:
- Por la evaporación del agua de mar o del agua de lagos salados.
- Minando la roca de sal, que es el mineral halita.
En 2002, se produjeron alrededor de 210 millones de toneladas de sal en todo el mundo. Los países que más sal produjeron fueron Estados Unidos, China, Alemania, India y Canadá.
¿Por qué es importante la sal para nuestro cuerpo?
El sodio (Na+) es muy importante para el funcionamiento de nuestras células. Ayuda a regular el equilibrio de líquidos y es fundamental para que los nervios transmitan señales. La mayor parte del sodio que necesitamos lo obtenemos de la sal de mesa.
¿Para qué se usa la sal?
La sal tiene muchos usos, tanto en casa como en la industria. Cada año se producen alrededor de 250 millones de toneladas de sal.
La sal como conservante de alimentos
La sal tiene la capacidad de quitar el agua a los virus y bacterias. Por eso, se usa para desinfectar heridas, aunque puede doler un poco.
Pocos microorganismos pueden sobrevivir en ambientes muy salados. Un ejemplo son las Artemias, unos pequeños crustáceos que viven en aguas muy saladas. También hay bacterias, como la B. marismortui, que se encuentran en el mar Muerto y pueden vivir en esas condiciones.
La salazón de la carne es una forma antigua de conservarla. Al añadir sal, se evita que las bacterias la descompongan. La sal extrae el agua de los alimentos, lo que impide que las bacterias crezcan y los echen a perder.
Usos de la sal en la industria
La sal se usa en muchas industrias. Por ejemplo, en la extracción de petróleo y gas, es un componente importante de los líquidos que se usan para perforar pozos. Ayuda a que el líquido sea más denso y controle la presión.
En la industria textil y de tintes, la sal se usa para limpiar y para ayudar a que los tintes se adhieran a las telas. También se utiliza en la fabricación de aluminio, berilio, cobre, acero y vanadio.
En la industria del papel, la sal se usa para blanquear la pulpa de madera. También se usa para fabricar clorato sódico, que a su vez se usa para producir dióxido de cloro, un blanqueador. En el curtido de cuero, la sal se añade a las pieles de animales para evitar que los microbios actúen y para que las pieles absorban humedad.
En la fabricación de caucho, la sal se usa para producir tipos de caucho sintético como el buna y el neopreno. También se añade sal al suelo para hacerlo más firme y estable, especialmente en la construcción de carreteras.
La sal también es un desecante barato y seguro. Esto significa que absorbe la humedad. Por eso, la salazón ha sido un método eficaz para conservar alimentos a lo largo de la historia. La sal extrae el agua de las bacterias, impidiendo que se reproduzcan y causen el deterioro de los alimentos.
La sal para derretir el hielo
El cloruro de sodio, en forma de salmuera (agua con mucha sal), es el producto más común para derretir el hielo y la nieve en las carreteras. Cuando la sal se disuelve en el agua, hace que el punto de congelación del agua baje. Esto significa que el agua se congela a una temperatura más baja de lo normal.
Para evitar que se forme hielo, a veces se rocían las carreteras con salmuera antes de que nieve. Esto impide que la nieve se pegue a la superficie. Para derretir el hielo ya formado, se usan mezclas de salmuera y sal, a veces con otros productos como cloruro de calcio. Sin embargo, la sal deja de ser efectiva para derretir el hielo por debajo de los -10 °C.
En el Reino Unido, la sal para las carreteras proviene principalmente de una mina en Winsford. Antes de distribuirla, se le añade una pequeña cantidad de ferrocianuro de sodio para evitar que se apelmace.
¿Cómo afecta la sal al medio ambiente?
La sal que se usa en las carreteras puede terminar en ríos y lagos. Esto puede dañar a las plantas y animales acuáticos, ya que altera su capacidad de regular el agua en sus cuerpos. La sal también puede causar corrosión en puentes, vehículos y estructuras de acero.
El agua de la lluvia y el viento pueden llevar la sal al suelo, a las plantas cerca de las carreteras y a las fuentes de agua. Aunque se ha visto que la sal aumenta en el ambiente durante los meses de invierno, las lluvias de primavera suelen diluirla. Un estudio de 2009 encontró que gran parte de la sal usada en las carreteras de Minneapolis-Saint Paul se queda en la zona.
La sal y las plantas
El sodio es un nutriente que las plantas necesitan en muy pequeñas cantidades. Algunas plantas especiales, como las plantas C4, necesitan un poco más.
Sin embargo, demasiada sal en el suelo es dañina para la mayoría de las plantas. La sal hace que el agua salga de las plantas por ósmosis, lo que las deshidrata. Un signo de esto son las puntas de las hojas quemadas. Solo las plantas llamadas halófitas pueden vivir en suelos con mucha sal, ya que han desarrollado formas de evitar la pérdida de agua.
La sal en la comida y la agricultura
Muchos microorganismos no pueden vivir en un ambiente salado porque la sal extrae el agua de sus células. Por eso, la sal se usa para conservar alimentos como el tocino, el pescado o el repollo.
La sal se añade a los alimentos para mejorar su sabor, conservarlos, ayudar a que los ingredientes se unan, controlar la fermentación, mejorar la textura y realzar el color. Se usa en la carne, productos enlatados, panadería, productos lácteos y cereales. Por ejemplo, en el tocino y el jamón, la sal ayuda a desarrollar el color. En los embutidos, ayuda a que la carne, la grasa y la humedad se unan.
En la industria láctea, la sal se añade al queso para controlar el color, la fermentación y la textura. En los productos enlatados, es un potenciador del sabor y conservante. En la panadería, la sal controla la velocidad de fermentación de la masa y fortalece el gluten. También se usa para dar sabor a productos como las patatas fritas y los pretzels.
En medicina veterinaria, el cloruro de sodio se usa para inducir el vómito en animales.
La sal en la medicina
La sal es el antídoto natural para el nitrato de plata. Ayuda al cuerpo a transformar el nitrato de plata en cloruro de plata, una sustancia que no es tóxica y que el cuerpo puede eliminar de forma segura.
|
Véase también
 En inglés: Table salt Facts for Kids
En inglés: Table salt Facts for Kids