Ósmosis para niños
La ósmosis es un fenómeno físico muy interesante que ocurre cuando un líquido, llamado disolvente (como el agua), se mueve a través de una membrana semipermeable. Imagina esta membrana como una barrera con agujeros tan pequeños que solo dejan pasar las moléculas más diminutas, como las del agua, pero no las más grandes, como las del azúcar. Este movimiento del disolvente sucede sin que se gaste energía.
La ósmosis es muy importante en la biología, especialmente para el funcionamiento de las células en todos los seres vivos. Ayuda a que las células mantengan el equilibrio de agua que necesitan para vivir.
Contenido
Descubrimiento de la ósmosis
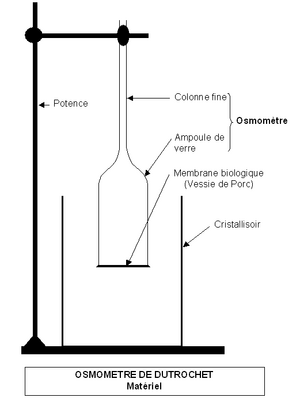
La historia de la ósmosis comenzó hace mucho tiempo. En 1748, un científico llamado Jean Antoine Nollet notó que si separaba agua y alcohol con la vejiga de un animal, el agua pasaba hacia el alcohol, pero el alcohol no pasaba hacia el agua.
Más tarde, entre 1827 y 1832, Henri Dutrochet estudió este fenómeno y le dio los nombres de "endosmosis" y "exosmosis". Por eso, a menudo se le considera el descubridor de la ósmosis.
En 1854, el químico escocés Thomas Graham, que trabajaba con sustancias especiales llamadas coloides, descubrió que estas no podían pasar a través de una membrana animal. Fue él quien usó por primera vez la palabra "ósmosis", que viene del griego "ὠσμός", que significa 'empuje'.
Avances en el estudio de la ósmosis
En 1864, M. Traube creó la primera membrana artificial usando un material llamado ferrocianuro de cobre. Luego, en 1877, Wilhelm Friedrich Philipp Pfeffer mejoró esta idea, haciendo membranas más resistentes.
En 1884, Hugo de Vries investigó cómo las células de las plantas se hinchaban o encogían debido a la ósmosis.
Un gran avance llegó en 1886, cuando Jacobus Henricus van 't Hoff explicó la ósmosis usando principios de la termodinámica. Él propuso el término "semipermeable" para describir las membranas y recibió el Premio Nobel de Química en 1901 por su importante trabajo.
¿Cómo funciona la ósmosis?
Para entender la ósmosis, primero debemos saber qué es una membrana semipermeable. Es como un filtro con poros muy, muy pequeños, a nivel molecular. Estos poros son tan diminutos que solo dejan pasar moléculas pequeñas, como las del agua, pero no las grandes, como las del azúcar.
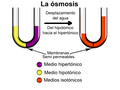
Imagina que tienes un recipiente dividido en dos partes por una membrana semipermeable. En un lado pones agua pura y en el otro, agua con azúcar. Lo que sucede es que las moléculas de agua se moverán de forma natural desde el lado donde hay más agua pura (menos concentración de azúcar) hacia el lado donde hay agua con azúcar (más concentración de azúcar).
Aunque el agua se mueve en ambas direcciones, hay un flujo mayor de moléculas de agua que van del lado con menos azúcar al lado con más azúcar. Esto ocurre hasta que las concentraciones de agua y azúcar se equilibran a ambos lados de la membrana.
En resumen, el agua siempre se mueve desde la zona con menos concentración de soluto (llamada disolución hipotónica) hacia la zona con mayor concentración de soluto (disolución hipertónica). Cuando las concentraciones se igualan, las disoluciones se llaman isotónicas.
La ósmosis en las células
En los seres vivos, las membranas de las células son semipermeables. Esto significa que el movimiento del agua es crucial para ellas:
Ósmosis en una célula animal
Si una célula animal está en un líquido con menos concentración de soluto (hipotónico), absorberá mucha agua y se hinchará. Podría incluso explotar, un proceso llamado citólisis. Si está en un líquido con más concentración de soluto (hipertónico), el agua saldrá de la célula, haciendo que se encoja y se deshidrate, lo que se conoce como crenación.
Ósmosis en una célula vegetal
Las células vegetales también tienen membranas semipermeables. En un medio hipotónico, la célula absorbe agua y sus vacuolas se llenan, haciendo que la célula se ponga firme. Esto se llama turgencia. Si está en un medio hipertónico, el agua sale de la célula y la pared celular se separa de la membrana, un proceso llamado plasmólisis.
Ósmosis inversa
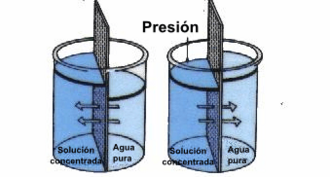
La ósmosis inversa es lo contrario de la ósmosis normal. En la ósmosis normal, el agua se mueve de una zona de baja concentración a una de alta concentración. Pero si aplicamos presión al lado de mayor concentración, podemos forzar al agua a pasar al lado de baja concentración.
En la ósmosis inversa, solo el agua pura atraviesa la membrana semipermeable. Los solutos (como la sal) se quedan atrás. Por ejemplo, si aplicamos presión al agua de mar en un lado de la membrana, el agua pura pasará al otro lado, dejando la sal. Así es como se puede desalinizar el agua de mar para hacerla potable.
Usos de la ósmosis inversa
La ósmosis inversa tiene muchas aplicaciones importantes, especialmente para separar sustancias disueltas del agua.
Desalinización de agua
Es uno de los usos más conocidos. Permite obtener agua dulce (con muy pocas sales) a partir de agua salobre o agua de mar. Las plantas desalinizadoras usan este método para convertir el agua salada en agua apta para el consumo humano. Es un sistema muy eficiente y se usa en barcos, aviones, industrias, hospitales y hogares.
Reducción de la dureza del agua
El agua "dura" contiene minerales como calcio y magnesio que pueden acumularse en las tuberías y electrodomésticos. La ósmosis inversa ayuda a reducir estos minerales, evitando que se formen depósitos.
Tratamiento de aguas residuales
La ósmosis inversa se usa para limpiar aguas contaminadas. Permite concentrar los contaminantes en un volumen pequeño, recuperar productos valiosos o reutilizar el agua tratada. Por ejemplo, puede eliminar nitratos del agua subterránea o ayudar a limpiar el agua de procesos industriales.
Eliminación de nitratos
Las aguas subterráneas a veces tienen muchos nitratos. Las membranas de ósmosis inversa pueden retener la mayoría de estos iones, haciendo que el agua sea más segura.
Eliminación de color y otras sustancias
También se usa para quitar el color del agua, que a veces proviene de la materia orgánica, y para eliminar otras sustancias no deseadas.
Tratamiento de residuos industriales
La ósmosis inversa es útil para tratar residuos de la producción de vino (vinazas), de la extracción de aceite de oliva (alpechines) y de otros procesos industriales, permitiendo recuperar agua y a veces otros materiales valiosos.
Producción de agua de alta calidad
- Agua desmineralizada: Las membranas de ósmosis inversa eliminan la mayoría de las sales del agua.
- Agua ultrapura: Además de sales, también elimina microorganismos y otras sustancias, produciendo agua de muy alta pureza para usos especiales.
Usos industriales diversos
Se utiliza en circuitos de refrigeración para ahorrar agua, en el pintado por electrodeposición de carrocerías de coches para recuperar pintura y agua, en el tintado de fibras textiles para reciclar químicos y agua, en la fabricación de catalizadores y en el procesado de papel fotográfico para recuperar plata y agua.
Usos en la industria alimentaria
La ósmosis inversa es excelente para concentrar alimentos sin dañarlos.
- Fabricación de fécula de patata: Ayuda a limpiar las aguas residuales y recuperar proteínas.
- Concentrado de zumos de frutas: Permite concentrar zumos a temperatura ambiente, conservando las vitaminas y el aroma sin gastar mucha energía.
- Preconcentrado de jugos azucarados: Reduce la cantidad de agua en los jugos azucarados antes de otros procesos, ahorrando energía.
- Preconcentrado de suero lácteo y clara de huevo: Reduce los costos de transporte y mejora la calidad de estos productos al eliminar agua.
- Estabilización de vinos: Ayuda a eliminar sustancias que pueden formar precipitados en el vino.
- Fabricación de bebidas con bajo contenido de alcohol: Permite producir bebidas con sabor normal y luego reducir su contenido de alcohol.
- Producción de alcohol: Se usa para concentrar el alcohol de los jugos azucarados durante la fermentación.
Experimento sencillo de ósmosis
Puedes hacer un experimento para ver la ósmosis. Necesitas una bolsa de celofán (como las que se usan para envolver dulces) y una solución de agua con azúcar. Llena la bolsa con la solución de agua y azúcar y ciérrala muy bien. Luego, sumérgela en un recipiente con agua pura.
El celofán actúa como una membrana semipermeable: no deja pasar las moléculas de azúcar, pero sí las de agua. Al principio, la bolsa estará normal, pero poco a poco verás cómo se hincha. Esto ocurre porque el agua del recipiente se mueve a través del celofán hacia el interior de la bolsa, donde hay más azúcar. Este es el fenómeno de la ósmosis en acción.
Ver también
- Acuaporina
- Bebida isotónica
- Difusión
- Hipotónico, isotónico e hipertónico
- Membrana semipermeable
- Nanofiltración
- Osmolaridad
- Ósmosis forzada
- Ósmosis inversa
- Osmotrofia
- Plasmólisis
- Ultrafiltración
Galería de imágenes
Véase también
 En inglés: Osmosis Facts for Kids
En inglés: Osmosis Facts for Kids