Clorato de potasio para niños
Datos para niños
Clorato de potasio |
||
|---|---|---|
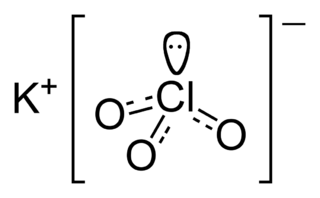 |
||
| Nombre IUPAC | ||
| Trioxoclorato (V) de potasio | ||
| General | ||
| Otros nombres | Clorato potásico Clorato de potasio |
|
| Fórmula estructural | 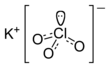 |
|
| Fórmula molecular | KClO3 | |
| Identificadores | ||
| Número CAS | 3811-04-9 | |
| Número RTECS | FO0350000 | |
| ChEMBL | CHEMBL3188561 | |
| ChemSpider | 18512 | |
| PubChem | 6426889 | |
| UNII | H35KS68EE7 | |
|
InChI
InChI=InChI=1S/ClHO3.K/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1
Key: VKJKEPKFPUWCAS-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 2.32 × 10³ kg/m³; 2,32 g/cm³ | |
| Masa molar | 122,55 g/mol | |
| Punto de fusión | 629 K (356 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 7.31 g/100 ml | |
| Peligrosidad | ||
| NFPA 704 |
0
2
3
OX
|
|
| Compuestos relacionados | ||
| Aniones relacionados | KBrO3 KIO3 |
|
| Cationes relacionados | NH4ClO3 NaClO3 |
|
| Otros compuestos | KCl KClO KClO2 KClO4 |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El clorato de potasio (también conocido como clorato potásico) es un compuesto químico. Se forma cuando el anión clorato se une con el catión potasio. En su estado puro, se presenta como cristales de color blanco. Es uno de los cloratos más usados en la industria y se encuentra en muchos laboratorios. Se utiliza principalmente como un oxidante, lo que significa que ayuda a otras sustancias a reaccionar con el oxígeno. También se usa en procesos de pavonado y en la fabricación de fuegos artificiales.
El clorato de potasio es seguro a temperatura ambiente por sí solo. Sin embargo, si se mezcla con materiales que pueden quemarse o reaccionar fácilmente, puede volverse sensible al calor. Cuando se combina con elementos como el azufre y el fósforo, se vuelve inestable y puede reaccionar con fuerza si hay fricción o un golpe. Por esta razón, se usó en el pasado para ciertas partes de armas de fuego que inician la combustión. Para los fuegos artificiales, se ha reemplazado en gran parte por el perclorato de potasio, que es más estable.
Contenido
¿Cómo se produce el clorato de potasio?
A nivel industrial, el clorato de potasio se fabrica mediante una reacción química llamada "metátesis". En esta reacción, se combinan clorato de sodio y cloruro de potasio.
<chem>NaClO3 + KCl -> NaCl + KClO3</chem>
Esta reacción funciona bien porque el clorato de potasio no se disuelve fácilmente en agua. Al precipitarse (separarse como un sólido), la reacción sigue adelante. El clorato de sodio, que es el punto de partida, se produce en grandes cantidades usando electrólisis de cloruro de sodio (la sal de mesa común).
A veces, también se produce clorato de potasio directamente por electrólisis de cloruro de potasio en agua. En este proceso, el cloro que se forma en el ánodo reacciona con el hidróxido de potasio que está presente. Como el clorato de potasio no se disuelve mucho en agua, es fácil separarlo de la mezcla.
También se puede hacer clorato de potasio en pequeñas cantidades. Esto se logra primero con una reacción de hipoclorito de sodio y luego con una reacción de metátesis usando cloruro de potasio:
- <chem>3 NaOCl -> 2 NaCl + NaClO3</chem>
Otra forma de producirlo es haciendo pasar gas cloro a través de una solución caliente de potasa cáustica:
<chem>3 Cl2 + 6 KOH -> KClO3 + 5 KCl + 3 H2O</chem>
¿Para qué se usa el clorato de potasio?
El clorato de potasio fue un componente importante en las primeras partes de las armas de fuego que inician la combustión. Todavía se usa en esta aplicación, aunque a veces se prefiere el perclorato de potasio.
Las sustancias que ayudan a impulsar objetos, hechas con clorato, son más eficientes que la pólvora tradicional. Además, son menos afectadas por el agua. Sin embargo, pueden ser muy inestables si están cerca de azufre o fósforo y son más costosas. Estas sustancias solo deben usarse en equipos diseñados para ellas, ya que no seguir esta precaución puede causar accidentes. El clorato de potasio se usa en algunos fuegos artificiales que hacen ruido, como los "crackers" o "pop-its".
Otra forma de usar el clorato de potasio es como oxidante en mezclas que producen humo, como las que se encuentran en las granadas de humo. Desde 2005, se usa una mezcla de clorato de potasio con lactosa y colofonia para generar el humo blanco que indica la elección de un nuevo Papa.
En los laboratorios de escuelas y universidades, el clorato de potasio se usa para producir gas oxígeno. Es una forma más económica de obtener oxígeno que usar tanques especiales. El clorato de potasio se descompone fácilmente cuando se calienta y está en contacto con un catalizador, como el dióxido de manganio (IV) (MnO~2~). Se puede calentar en un tubo de ensayo sobre un quemador para obtener oxígeno caliente. La reacción es:
<chem>2 KClO3(s) ->[\Delta][MnO_2] 3 O2(g) + 2 KCl(s)</chem>
Si se calienta sin un catalizador, se convierte en perclorato de potasio:
<chem>4 KClO3 -> 3 KClO4 + KCl</chem>
Si se sigue calentando, el perclorato de potasio se descompone en cloruro de potasio y oxígeno:
<chem>KClO4 -> KCl + 2O2</chem>
Para que estas reacciones sean seguras, se necesitan sustancias muy puras y un control cuidadoso de la temperatura. El clorato de potasio derretido es un oxidante muy potente y puede reaccionar de forma espontánea con muchos materiales comunes, como el azúcar. Se han producido incidentes cuando el clorato líquido ha salpicado en tubos de goma o plástico, o por contacto con grasas selladoras. Las impurezas en el clorato de potasio también pueden causar problemas. Cuando se usa un nuevo lote, es buena idea probar una pequeña cantidad (aproximadamente 1 gramo) calentándola con fuerza en una superficie abierta. Si esta pequeña cantidad reacciona de forma inesperada, significa que el clorato no es seguro y debe desecharse.
El clorato de potasio también se usa en generadores químicos de oxígeno, que son sistemas para proporcionar oxígeno en lugares como aviones, estaciones espaciales y submarinos. Es importante que estos sistemas se manejen con mucho cuidado.
Además, el clorato de potasio se utiliza en la agricultura para ayudar a que el árbol de longan florezca y produzca frutos en climas más cálidos.
En las escuelas, el clorato de potasio derretido se usa en demostraciones de química, como el experimento de los "dulces que gritan", donde se dejan caer dulces en la sal derretida.
En los laboratorios de química, se usa para oxidar ácido clorhídrico (HCl) y liberar pequeñas cantidades de gas cloro.
¿Es seguro el clorato de potasio?
El clorato de potasio debe manejarse con mucho cuidado. Reacciona con fuerza y, en algunos casos, puede encenderse o reaccionar de forma espontánea si se mezcla con muchos materiales que pueden quemarse. Arde con mucha intensidad si se combina con casi cualquier material combustible, incluso aquellos que normalmente no se encienden fácilmente (como el polvo o la pelusa). Las mezclas de clorato de potasio y un material combustible pueden encenderse al contacto con ácido sulfúrico, por lo que debe mantenerse alejado de este ácido. Es importante evitar el azufre en las mezclas de fuegos artificiales que contienen clorato de potasio, ya que estas combinaciones pueden encenderse de forma espontánea. La mayoría del azufre contiene pequeñas cantidades de ácidos que pueden causar esta ignición. Además, las mezclas de clorato de potasio con cualquier compuesto que promueva la ignición (como el trisulfuro de antimonio (III)) son muy peligrosas de preparar, ya que son extremadamente sensibles a los golpes.
Véase también
 En inglés: Potassium chlorate Facts for Kids
En inglés: Potassium chlorate Facts for Kids




