Pila de zinc-carbono para niños
Datos para niños Pila de zinc-carbono |
||
|---|---|---|
 Pilas de zinc-carbono, de diferentes tamaños
|
||
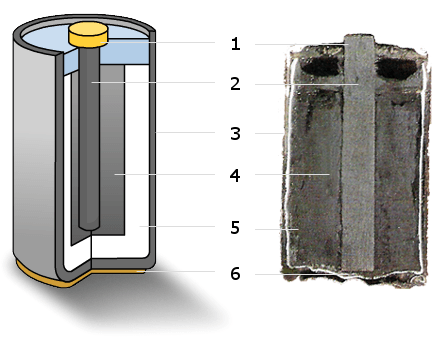
| Ánodo | Zinc | |
| Cátodo | Barra de carbono o una barra de grafito rodeada por una mezcla de dióxido de manganeso, negro de acetileno y polvo de carbón | |
| Electrolito | Pasta de cloruro de zinc o cloruro de amonio, disuelto en agua | |
Una pila de zinc-carbono es un tipo común de pila seca, también conocida como pila salina. Fue desarrollada a partir de una pila más antigua llamada pila Leclanché.
Esta pila tiene un recipiente exterior de zinc que funciona como el polo negativo (llamado ánodo). Dentro, se encuentra el polo positivo (llamado cátodo), que suele ser una barra de carbono o grafito. Esta barra está rodeada por una mezcla de dióxido de manganeso y polvo de carbón. El líquido especial que permite que la electricidad fluya, llamado electrolito, es una pasta hecha de cloruro de zinc y cloruro de amonio disueltos en agua. Las pilas de cloruro de zinc son una versión mejorada de las originales. En los envases, a menudo se identifican con la letra "R".
Las pilas de zinc-carbono son las más económicas. Por eso, muchos fabricantes las incluyen con sus aparatos. Se les conoce como pilas de "uso general". Son útiles para dispositivos que no necesitan mucha energía, como mandos a distancia, linternas pequeñas, relojes o radios portátiles.
Contenido
Historia de las pilas de zinc-carbono
¿Cómo se desarrollaron las pilas secas?
En 1876, la pila Leclanché, que usaba líquidos, fue mejorada al añadir un bloque de dióxido de manganeso. Más tarde, en 1886, el Dr. Carl Gassner creó una versión "seca". Él usó un recipiente de zinc como polo negativo y convirtió el electrolito en una pasta sólida con yeso o harina.
Primeras aplicaciones y mejoras
En 1898, Conrad Hubert usó estas pilas para crear la primera linterna. Después, él y WH Lawrence fundaron la compañía de pilas Ever Ready. En 1900, Gassner mostró sus pilas secas para iluminación portátil en la Feria Mundial de París. A lo largo del siglo XX, las pilas de zinc-carbono mejoraron mucho. Su capacidad se multiplicó por cuatro gracias a un dióxido de manganeso más puro, un mejor sellado y el uso de zinc más puro.
¿Por qué no se pueden recargar?
Una pila de zinc-carbono se llama una celda primaria. Esto significa que, una vez que sus componentes químicos se agotan, no está hecha para ser recargada y debe desecharse. A veces, se han vendido aparatos que prometen recargar estas pilas, pero sus efectos son temporales y pueden causar fugas o incluso explosiones. Por eso, nunca se deben intentar recargar.
¿Por qué las pilas de zinc-carbono pueden tener fugas?
Estas pilas son propensas a las fugas porque el recipiente de zinc, que es el polo negativo, se va desgastando mientras la pila se usa. Cuando el zinc se vuelve muy delgado, el electrolito puede salirse. Una pila vieja que tiene fugas puede dañar los aparatos electrónicos. La pasta que se escapa es pegajosa. La vida útil de estas pilas es corta, aproximadamente 1.5 años. El recipiente de zinc se adelgaza incluso si la pila no se usa, porque el cloruro de amonio dentro de la pila es ácido y reacciona con el zinc.
¿Cómo funcionan las pilas de zinc-carbono?
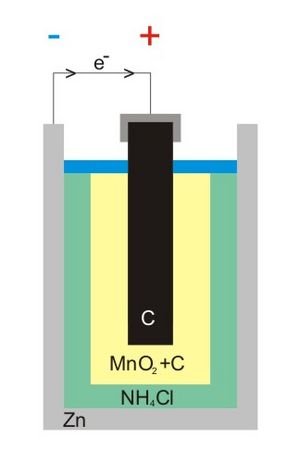
Dentro de una pila de zinc-carbono, el recipiente de zinc es el polo negativo. El zinc reacciona y libera electrones.
El polo positivo es una varilla de grafito rodeada por una mezcla de polvo de carbono y óxido de manganeso (IV). El dióxido de manganeso acepta los electrones que vienen del zinc.
Estas reacciones químicas producen una corriente eléctrica. La pila de zinc-carbono genera aproximadamente 1.5 V. A medida que la pila se usa, las reacciones químicas hacen que su resistencia interna aumente, y el voltaje puede disminuir.
Tensión y duración de las pilas
¿Cuánto duran las pilas de zinc-carbono?
Las pilas de zinc-carbono están diseñadas para usarse de forma intermitente, es decir, encendiéndolas y apagándolas. Su duración depende de cuánta energía se les pida:
- Si se usan con mucha intensidad, durarán menos y su voltaje bajará rápido.
- Si se usan con poca intensidad, durarán más tiempo y el voltaje se mantendrá más estable.
Esto ocurre porque los materiales químicos dentro de la pila necesitan tiempo para reaccionar y recuperarse.
La pila de cloruro de zinc
¿Qué es una pila "Heavy Duty"?
La pila de cloruro de zinc es una versión mejorada de la pila de zinc-carbono original. Usa químicos más puros, lo que le da una vida útil más larga y un voltaje más constante. A menudo se venden con la etiqueta "Heavy Duty" (uso rudo) para distinguirlas de las pilas de zinc-carbono "de uso general". Esto a veces causa confusión con las pilas alcalinas, que duran aún más. La principal diferencia es que la pila de cloruro de zinc usa principalmente pasta de cloruro de zinc, con menos cloruro de amonio.
Conceptos clave: Ánodo y Cátodo
¿Qué significan ánodo y cátodo en una pila?
Las palabras ánodo y cátodo pueden ser un poco confusas. En las pilas que generan electricidad (como las de zinc-carbono), el ánodo es el polo negativo. Es donde los electrones son liberados. El cátodo es el polo positivo, donde los electrones son aceptados. La clave es recordar que el ánodo siempre es donde ocurre la oxidación (pérdida de electrones) y el cátodo es donde ocurre la reducción (ganancia de electrones).
Véase también
 En inglés: Zinc–carbon battery Facts for Kids
En inglés: Zinc–carbon battery Facts for Kids