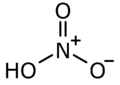
Ácido nítrico para niños
Datos para niños
Ácido nítrico |
||
|---|---|---|
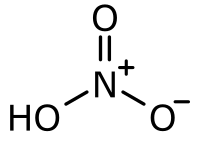 |
||
 |
||
| Nombre IUPAC | ||
| Ácido nítrico | ||
| General | ||
| Fórmula molecular | ?HNO3 | |
| Identificadores | ||
| Número CAS | 7697-37-2 | |
| ChEBI | CHEBI:48107 | |
| ChEMBL | CHEMBL1352 | |
| ChemSpider | 919 | |
| PubChem | 944 | |
| UNII | 411VRN1TV4 | |
| Propiedades físicas | ||
| Apariencia | Líquido fumante incoloro, amarillento o rojizo | |
| Olor | Acre, sofocante | |
| Densidad | 1512,9 kg/m³; 1,5129 g/cm³ | |
| Masa molar | 63,01 g/mol | |
| Punto de fusión | 231 K (−42 °C) | |
| Punto de ebullición | 356 K (83 °C) | |
| Presión de vapor | 6399,5 Pa (48 mmHg) (a 20 °C) | |
| Índice de refracción (nD) | 1,397 (a 16,5 °C) | |
| Propiedades químicas | ||
| Acidez | −1,4 pKa | |
| Solubilidad en agua | Completamente miscible | |
| Momento dipolar | 2,17 ± 0,02 D | |
| Peligrosidad | ||
| SGA |
  |
|
| NFPA 704 |
0
4
1
OX
|
|
| Frases R | RR8 RR35 | |
| Frases S | SS1/2 SS23 SS26 SS36 SS45 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El ácido nítrico (HNO3) es un compuesto químico muy importante. Es un líquido que puede ser peligroso si no se maneja con cuidado, ya que es corrosivo y puede causar quemaduras. Se usa mucho en laboratorios y en la industria para fabricar diferentes productos.
Por ejemplo, se utiliza para crear fertilizantes que ayudan a las plantas a crecer, como el nitrato de amonio. También es útil en la metalurgia (el estudio y uso de los metales) y en el refinado de materiales, porque reacciona con la mayoría de los metales. En la síntesis química, ayuda a crear nuevas sustancias.
Cuando el ácido nítrico se mezcla con el ácido clorhídrico, forman una sustancia especial llamada agua regia. Esta mezcla es tan potente que puede disolver metales muy resistentes como el oro y el platino. El ácido nítrico también es una de las sustancias que contribuyen a la lluvia ácida.
Normalmente, el ácido nítrico puro no tiene color. Sin embargo, si se guarda por mucho tiempo, puede volverse un poco amarillo. Esto ocurre porque se descompone y forma óxido de nitrógeno. La mayoría del ácido nítrico que se vende tiene una concentración del 68% en agua. Si la solución tiene más del 86% de HNO3, se le llama ácido nítrico fumante. Este puede ser de color rojo o blanco, dependiendo de la cantidad de dióxido de nitrógeno que contenga.
El ácido nítrico es muy importante para un proceso llamado nitración. En este proceso, se añade un grupo químico llamado "grupo nitro" a otras moléculas. Algunos de los productos de la nitración se usan en la fabricación de materiales para diversas industrias, incluyendo algunos que se usan en la construcción y la minería. Otros se usan como pigmentos en tintas y tintes. El ácido nítrico también es un agente oxidante muy fuerte, lo que significa que puede causar reacciones químicas intensas.
Contenido
¿Cómo se produce el ácido nítrico?
El ácido nítrico se puede obtener mezclando pentóxido de dinitrógeno (N2O5) con agua. Para obtener ácido nítrico muy puro, a menudo se usa un proceso de destilación con ácido sulfúrico. Esto se debe a que el ácido nítrico y el agua forman una mezcla especial (llamada azeótropo) con un 68% de ácido nítrico y un 32% de agua.
Las soluciones de ácido nítrico que se venden suelen tener entre un 52% y un 68% de ácido. Si la solución tiene más del 86% de ácido nítrico, se le llama ácido nítrico fumante. Este puede ser de dos tipos: blanco o rojo. El ácido nítrico fumante blanco es casi 100% puro, con muy poca agua (menos del 1%).
Fabricación industrial del ácido nítrico
A gran escala, el ácido nítrico se fabrica a partir de amoníaco y oxígeno. Estos dos elementos se combinan en un gran recipiente llamado reactor. Dentro del reactor, se usa un catalizador de metal, que es una sustancia que acelera la reacción química sin consumirse.
Para esta reacción, se necesitan temperaturas muy altas (entre 700 y 900 grados Celsius). Por eso, se usan metales que pueden soportar este calor sin cambiar, como el platino mezclado con rodio.
Propiedades del ácido nítrico
El ácido nítrico tiene características físicas y químicas muy particulares.
Propiedades físicas del ácido nítrico
El ácido nítrico puro es un líquido espeso, sin color ni olor. Sin embargo, a menudo tiene un color amarillo o marrón debido a pequeñas impurezas. A temperatura ambiente, libera vapores amarillos. Si el ácido nítrico concentrado toca la piel, puede dejarla de color amarillo. Esto ocurre por una reacción con una proteína de la piel llamada queratina.
Aquí tienes algunas de sus propiedades físicas:
- Punto de ebullición: 83 grados Celsius
- Punto de fusión: -41.6 grados Celsius
- Densidad relativa (comparada con el agua): 1.4
- Solubilidad en agua: Se mezcla completamente con el agua.
- Presión de vapor a 20 grados Celsius: 6.4 kPa
- Densidad relativa de vapor (comparada con el aire): 2.2
Propiedades químicas del ácido nítrico
El ácido nítrico es un agente oxidante muy potente. Esto significa que puede causar reacciones fuertes con otras sustancias. Por ejemplo, sus reacciones con algunos compuestos como los cianuros o los carburos pueden ser muy intensas. También reacciona de forma violenta con muchos compuestos orgánicos, como la trementina, llegando a encenderse por sí sola.
Es un ácido fuerte. Cuando se disuelve en agua, se separa completamente en iones nitrato (NO3-) y protones. Las sales que se forman con el ácido nítrico se llaman nitratos.
¿Por qué el ácido nítrico cambia de color?
El ácido nítrico puede descomponerse por el calor o la luz. Por eso, a menudo se guarda en botellas de vidrio oscuro. Esta descomposición produce dióxido de nitrógeno (NO2) y oxígeno.
La reacción es la siguiente:
- 4 HNO
3 → 2 H
2O + 4 NO
2 + O
2
El dióxido de nitrógeno que se produce puede disolverse en el ácido, dándole un color amarillo o incluso rojo si la temperatura es más alta. Cuando el ácido puro se expone al aire, libera vapores blancos. Pero si tiene dióxido de nitrógeno disuelto, libera vapores de color marrón rojizo. Por eso se habla de "ácido nítrico fumante rojo" y "ácido nítrico fumante blanco".
Tipos de ácido nítrico fumante
El ácido nítrico fumante de uso comercial suele contener un 98% de HNO3. Es menos volátil y menos corrosivo que el ácido nítrico puro sin agua.
El ácido nítrico fumante rojo (RFNA) contiene una cantidad importante de dióxido de nitrógeno disuelto, lo que le da su color marrón rojizo.
Existe también el ácido nítrico fumante inhibido, que puede ser blanco o rojo. Se fabrica añadiendo una pequeña cantidad de fluoruro de hidrógeno (HF), entre un 0.6% y un 0.7%. Este fluoruro ayuda a proteger los recipientes de metal de la corrosión, creando una capa protectora.
Ácido nítrico anhidro (puro)
El ácido nítrico fumante blanco (WFNA) es muy similar al ácido nítrico anhidro, que es casi 100% puro (99.9%). Una característica del ácido nítrico fumante blanco es que tiene un máximo de 2% de agua y un máximo de 0.5% de NO2 disuelto.
El ácido nítrico anhidro es un líquido sin color que se vuelve sólido a -42 grados Celsius, formando cristales blancos. Cuando se descompone, adquiere un tono amarillo. Hierve a 83 grados Celsius. Se suele guardar en botellas de vidrio oscuro y resistente, con espacio extra para que la presión no se acumule. Aun así, es necesario ventilar la botella cada mes para liberar la presión.
Usos del ácido nítrico
El ácido nítrico tiene muchas aplicaciones importantes en diferentes campos:
- Se usa para la nitración en la fabricación de materiales para diversas industrias.
- Es fundamental en la fabricación de abonos para la agricultura. Por ejemplo, el nitrosulfato amónico es un tipo de abono que se obtiene de la reacción del ácido nítrico y sulfúrico con amoniaco.
- Se emplea en algunos procesos de pasivación, que es una técnica para proteger metales de la corrosión.
- En el grabado artístico, se utiliza para crear diseños en metal (técnica del aguafuerte). También se usa para verificar la pureza del oro y el platino.
- En la industria electrónica, es un componente clave en la elaboración de placas de circuito impreso (PCBs), que son la base de muchos aparatos electrónicos.
- En la industria farmacéutica, se usa para separar ciertos compuestos.
Historia del ácido nítrico
Se cree que los ácidos minerales como el ácido nítrico fueron descubiertos en Europa alrededor del siglo XIII, durante la época de la alquimia. Aunque algunos textos árabes antiguos podrían mencionarlo, la mayoría de los expertos creen que fue descrito por primera vez en un libro llamado De inventione veritatis (Sobre el descubrimiento de la verdad), escrito después del año 1300.
También hay recetas para preparar ácido nítrico en un tratado latino llamado Liber Luminis luminum, que se atribuye a Michael Scot, quien vivió antes de 1236. Otros escritos, atribuidos a Alberto Magno y Ramon Llull, también describen cómo preparar este ácido destilando una mezcla de salitre y vitriolo verde. Ellos lo llamaban "agua fuerte" (aqua fortis).
En el siglo XVII, un científico llamado Johann Rudolf Glauber encontró una forma de obtener ácido nítrico destilando nitrato potásico con ácido sulfúrico. Más tarde, en 1776, Antoine Lavoisier y Joseph Priestley descubrieron que se podía formar a partir de óxido nítrico, oxígeno y agua. En 1785, Henry Cavendish determinó su composición exacta y demostró que se podía crear pasando chispas eléctricas a través de aire húmedo. En 1806, Humphry Davy observó que el ácido nítrico se producía en el ánodo durante la electrólisis del agua.
La producción industrial de ácido nítrico a partir del aire comenzó en 1905 con el proceso Birkeland-Eyde. Este método usaba un arco eléctrico a muy alta temperatura para oxidar el nitrógeno del aire y convertirlo en óxido nítrico. Luego, este óxido se enfriaba y se oxidaba de nuevo para formar dióxido de nitrógeno, que se absorbía en agua para producir ácido nítrico diluido. Sin embargo, este proceso requería mucha energía.
Alrededor de 1913, el ingeniero francés Albert Nodon inventó otro método que producía ácido nítrico a partir de la electrólisis del nitrato de calcio, que se obtenía de la materia nitrogenada de las turberas.
Finalmente, cuando el proceso Haber permitió producir amoníaco de forma más barata en 1913, el proceso Ostwald para fabricar ácido nítrico a partir de amoníaco se volvió más popular que el proceso Birkeland-Eyde. Este método de producción sigue siendo el más utilizado hoy en día.
Galería de imágenes
Véase también
 En inglés: Nitric acid Facts for Kids
En inglés: Nitric acid Facts for Kids