Hidrazina para niños
Datos para niños
Hidrazina |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Hidrazina | ||
| General | ||
| Fórmula semidesarrollada | NH2-NH2 | |
| Fórmula estructural | 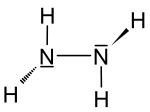 |
|
| Fórmula molecular | N2H4 | |
| Identificadores | ||
| Número CAS | 302-01-2 | |
| Número RTECS | MU7175000 | |
| ChEBI | 15571 | |
| ChEMBL | CHEMBL1237174 | |
| ChemSpider | 8960 | |
| PubChem | 9321 | |
| UNII | 27RFH0GB4R | |
| KEGG | C05361 | |
|
InChI
InChI=InChI=1S/H4N2/c1-2/h1-2H2
Key: OAKJQQAXSVQMHS-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1010 kg/m³; 1,01 g/cm³ | |
| Masa molar | 32,0 g/mol | |
| Punto de fusión | 274 K (1 °C) | |
| Punto de ebullición | 387 K (114 °C) | |
| Propiedades químicas | ||
| Acidez | 8,1±0,01 pKa | |
| Solubilidad en agua | Muy soluble | |
| Termoquímica | ||
| ΔfH0gas | 95,35 kJ/mol | |
| ΔfH0líquido | 50,63 kJ/mol | |
| ΔfH0sólido | 37,63 kJ/mol | |
| S0gas, 1 bar | 238,66 J·mol–1·K | |
| S0líquido, 1 bar | 121,52 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
3
3
3
|
|
| Riesgos | ||
| Ingestión | Tóxico, posiblemente un agente cancerígeno. | |
| Inhalación | Muy peligroso, extremadamente destructivo para el tracto respiratorio. | |
| Piel | Puede causar quemaduras severas, puede ser absorbido por la sangre. | |
| Ojos | Puede causar daños permanentes. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
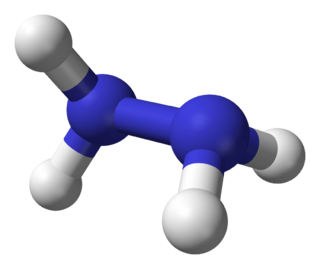
La hidrazina es un compuesto químico con la fórmula química N2H4. Es un líquido sin color, un poco aceitoso, con un olor parecido al del amoníaco. Cuando se expone al aire, libera vapores y puede quemarse con una llama casi invisible.
La hidrazina se usa en varias industrias. Se emplea para crear espumas en materiales plásticos y como base para fabricar catalizadores y algunos medicamentos. También es un combustible importante para aviones, misiles, cohetes espaciales y satélites. En estos casos, se suele usar junto con otro compuesto llamado tetrahidruro de dinitrógeno.
Existen otros compuestos parecidos a la hidrazina, llamados "hidrazinas". A menudo, en lugar de la hidrazina pura, se usan sus derivados, como la metilhidrazina o la dimetilhidrazina asimétrica. Estos derivados tienen ventajas, como poder guardarse a temperatura ambiente y encenderse al instante al entrar en contacto con el comburente (sustancia que ayuda a la combustión). A estos combustibles se les llama hipergólicos. Sin embargo, debido a que son muy dañinos, su uso se ha reducido.
Este compuesto químico reacciona con el oxígeno de una forma especial: N2H4 + O2 → N2 + 2 H2O. Esta reacción ayuda a evitar que los metales se oxiden y corroan. Además, al tocar el óxido férrico (óxido de hierro), forma magnetita, agua y nitrógeno: N2H4 + 6 Fe2O3 → 4 Fe3O4 + 2 H2O + N2.
El científico Theodor Curtius fue el primero en crear hidrazina pura en 1889, usando un proceso complejo.
Contenido
Estructura y características de la hidrazina
La hidrazina puede formar un compuesto con agua llamado monohidrato, que es un poco más denso que la hidrazina pura.
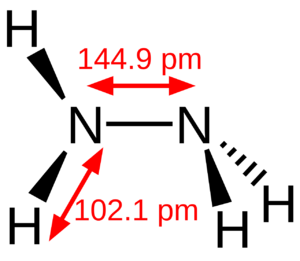
La molécula de hidrazina se puede formar uniendo dos moléculas de amoníaco y quitando una molécula de hidrógeno. Cada parte de la molécula tiene una forma piramidal. La distancia entre los dos átomos de nitrógeno es de 1.45 Å (145 picómetros).
La hidrazina tiene propiedades básicas (alcalinas), similares a las del amoníaco. Esto significa que puede aceptar protones (iones de hidrógeno) en una reacción química.
El calor que se libera cuando la hidrazina se quema en oxígeno (aire) es de 194.1 x 105 J/kg.
¿Cómo se fabrica la hidrazina?
La hidrazina se produce de varias maneras. Uno de los métodos más antiguos es el proceso de Olin Raschig, que se dio a conocer en 1907. En este proceso, se hace reaccionar hipoclorito de sodio (un ingrediente común en los blanqueadores) con amoníaco.
Otro método para fabricar hidrazina es oxidar la urea con hipoclorito de sodio.
También se puede sintetizar hidrazina a partir de amoníaco y peróxido de hidrógeno en un proceso llamado Pechiney-Ugine-Kuhlmann.
En el ciclo de Atofina-PCUK, la hidrazina se produce en varias etapas usando acetona, amoníaco y peróxido de hidrógeno. Este proceso es diferente al de Raschig porque no produce sal como subproducto.
La hidrazina también se puede obtener a través de otros métodos conocidos como los procesos de la cetazina y peróxido.
Precauciones con la hidrazina
La hidrazina es una sustancia que debe manejarse con mucho cuidado. Es importante saber que puede ser dañina, especialmente en su forma pura.
Según la Agencia de Protección Ambiental de EE. UU., si una persona se expone a altos niveles de hidrazina por un corto tiempo, podría sentir mareos, dolor de cabeza, náuseas e irritación en los ojos, nariz y garganta. También podría afectar órganos importantes como el hígado y los riñones. Si el líquido toca la piel, puede causar quemaduras.
Se ha observado que la exposición prolongada a la hidrazina puede causar problemas de salud en animales. Por estas razones, se realizan pruebas para asegurar que la cantidad de hidrazina en productos como los medicamentos sea muy pequeña.
En 2008, un satélite de Estados Unidos que estaba fuera de control fue destruido. Se dijo que su tanque de combustible contenía hidrazina y que era importante evitar que esta sustancia llegara a zonas pobladas.
También en 2008, hubo un accidente en San Carlos de Bariloche, Argentina, donde dos camiones que transportaban hidrazina chocaron. Afortunadamente, no hubo heridos graves, aunque uno de los conductores sintió mareos por haber inhalado la sustancia.
Véase también
 En inglés: Hydrazine Facts for Kids
En inglés: Hydrazine Facts for Kids
- 2,4-dinitrofenilhidrazina
- Hidrazina (grupo funcional)