Ácido acético para niños
Datos para niños
ácido acético |
||
|---|---|---|
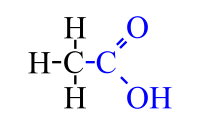
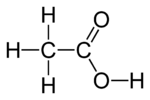 Estructura plana del ácido acético
|
||
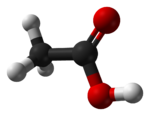 Estructura tridimensional del ácido acético
|
||
| Nombre IUPAC | ||
| ácido etanoico | ||
| General | ||
| Otros nombres | Ácido acético | |
| Fórmula semidesarrollada | CH3COOH | |
| Fórmula molecular | C2H4O2 | |
| Identificadores | ||
| Número CAS | 64-19-7 | |
| Número RTECS | AF1225000 | |
| ChEBI | 15366 | |
| ChEMBL | CHEMBL539 | |
| ChemSpider | 171 | |
| DrugBank | DB03166 | |
| PubChem | 176 | |
| UNII | Q40Q9N063P | |
| KEGG | D00010 | |
|
CC(O)=O
|
||
| Propiedades físicas | ||
| Apariencia | cristales | |
| Densidad | 1049 kg/m³; 1,049 g/cm³ | |
| Masa molar | 60,021129372 g/mol | |
| Punto de fusión | 290 K (17 °C) | |
| Punto de ebullición | 391,2 K (118 °C) | |
| Propiedades químicas | ||
| Acidez | 4,74 pKa | |
| Momento dipolar | 1,74 D | |
| Peligrosidad | ||
| SGA |   |
|
| NFPA 704 |
2
3
0
|
|
| Frases H | H226, H314 | |
| Frases P | P280, P305+P351+P338, P310 | |
| Riesgos | ||
| Ingestión | Dolor de garganta, vómito, diarrea, dolor abdominal, sensación de quemazón en el tracto digestivo. | |
| Inhalación | Dolor de garganta, dificultad respiratoria, tos. | |
| Piel | Quemadura. | |
| Ojos | Irritación, visión borrosa, quemaduras profundas. | |
| Compuestos relacionados | ||
| Ácidos relacionados | Ácido metanoico Ácido propílico Ácido butírico |
|
| Compuestos relacionados | Acetamida Acetato de etilo, Anhidrido acético, Acetonitrilo, Acetaldehído, Etanol, Cloruro de etanoilo |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El ácido acético es una sustancia química que se encuentra en el vinagre. Es lo que le da al vinagre su sabor y olor característicos. También se le conoce como ácido etanoico o ácido metilcarboxílico. Su fórmula química es CH3-COOH.
Es uno de los ácidos más sencillos que existen. Se presenta como un líquido transparente o cristales sin color. Tiene un punto de fusión de 16.6 °C y un punto de ebullición de 117.9 °C.
En el agua, el ácido acético puede liberar una pequeña parte de sí mismo, lo que lo convierte en un ácido débil. Esto significa que no es tan fuerte como otros ácidos y puede usarse para crear soluciones especiales que mantienen el pH estable.
El ácido acético es muy importante en la química y la biología. Se usa como un reactivo en experimentos y también es una parte clave de muchos procesos en los seres vivos.
Antiguamente, se obtenía de otras sustancias químicas. Hoy en día, la forma más común de producirlo es combinando metanol con monóxido de carbono.
Contenido
¿Cómo se produce el ácido acético?
El ácido acético se puede obtener de dos maneras principales: mediante procesos químicos en fábricas o a través de la fermentación con bacterias.
La producción con bacterias es importante para el vinagre que usamos en la comida. Esto se debe a que las leyes de alimentos exigen que el vinagre comestible provenga de un proceso biológico.
La mayor parte del ácido acético que se usa en la industria se fabrica a partir de metanol y monóxido de carbono. Otros métodos también se utilizan, pero en menor medida.
Cada año se producen millones de toneladas de ácido acético en el mundo. Los Estados Unidos producen aproximadamente la mitad de esta cantidad.
Producción a partir de metanol y monóxido de carbono
La forma más común de fabricar ácido acético es combinando metanol (un tipo de alcohol) con monóxido de carbono (un gas). Esta reacción se realiza con la ayuda de un catalizador, que es una sustancia que acelera la reacción sin consumirse.
La reacción ocurre en tres pasos:
- Primero, el metanol reacciona con otra sustancia para formar un compuesto intermedio.
- Luego, este compuesto intermedio se combina con el monóxido de carbono.
- Finalmente, el producto de esa reacción se mezcla con agua para obtener el ácido acético.
Este método es muy eficiente porque el metanol y el monóxido de carbono son materiales económicos.
Las primeras fábricas que intentaron usar este método tuvieron problemas porque el ácido acético es muy corrosivo. Sin embargo, en 1963, una empresa alemana llamada BASF encontró una forma de hacerlo de manera segura usando un catalizador de cobalto.
Más tarde, en 1968, se descubrió un catalizador aún mejor, hecho de rodio. Este nuevo catalizador permitía producir ácido acético a temperaturas más bajas y con menos subproductos. La empresa Monsanto fue la primera en usarlo a gran escala en 1970.
A finales de los años 90, la empresa BP desarrolló un catalizador aún más eficiente, basado en iridio. Este nuevo proceso es más amigable con el ambiente y ha reemplazado en gran parte al método anterior.
Producción por oxidación de acetaldehído
Antes de que se popularizara el método del metanol, la mayoría del ácido acético se producía oxidando acetaldehído. Este sigue siendo un método importante, aunque no tan competitivo.
El acetaldehído se puede obtener de sustancias como el butano o la nafta. Cuando estas sustancias se calientan con aire y ciertos metales, se forma ácido acético.
También se puede oxidar el acetaldehído directamente con oxígeno del aire para producir ácido acético. Con los catalizadores modernos, esta reacción es muy eficiente.
Este proceso puede generar otros productos útiles, como acetato de etilo. Estos se pueden separar fácilmente del ácido acético.
Producción por oxidación de etileno
Una empresa japonesa, Showa Denko, desarrolló un método más reciente para convertir el etileno en ácido acético en un solo paso. Este proceso usa un catalizador especial con paladio.
Se cree que este método es bueno para fábricas más pequeñas, dependiendo del costo del etileno en cada lugar.
Producción por fermentación oxidativa (vinagre)
Durante mucho tiempo, el ácido acético en forma de vinagre se ha producido usando bacterias del género Acetobacter. Estas bacterias pueden transformar el alcohol en vinagre si tienen suficiente oxígeno.
Se pueden usar diferentes bebidas con alcohol, como sidra, vino o cereales fermentados. La reacción que hacen estas bacterias es:
- <chem>C2H5OH{_{(l)}} + O2{_{(g)}} -> CH3COOH{_{(aq)}} + H2O{_{(l)}}</chem>
Si dejas una solución de alcohol diluida con estas bacterias en un lugar cálido y con aire, se convertirá en vinagre en unos meses. Los métodos industriales aceleran este proceso dándoles más oxígeno a las bacterias.
El "método rápido" o "método alemán", que se usó por primera vez en Alemania en 1823, aceleró la producción de vinagre de meses a semanas.
Hoy en día, la mayoría del vinagre se produce en grandes tanques agitados, donde se burbujea aire para dar oxígeno a las bacterias. Con este método, se puede producir vinagre con un 15% de ácido acético en solo 24 horas.
Producción por fermentación anaeróbica
Algunas bacterias que viven sin oxígeno (anaeróbicas), como las del género Clostridium, pueden producir ácido acético directamente de los azúcares. La reacción es:
- <chem>C6H12O6{_{(aq)}} -> 3CH3COOH{_{(aq)}}</chem>
Estas bacterias también pueden producir ácido acético a partir de sustancias más simples, como monóxido de carbono o una mezcla de dióxido de carbono e hidrógeno.
Aunque estas bacterias podrían ser más eficientes, son menos resistentes al ácido. Esto significa que solo pueden producir vinagre con una concentración muy baja de ácido acético. Por eso, sigue siendo más económico usar las bacterias Acetobacter para hacer vinagre.
Usos y aplicaciones del ácido acético
El ácido acético tiene muchos usos importantes en diferentes campos:
- En la apicultura: Se usa para controlar las larvas de las polillas de la cera, que pueden dañar los panales de las abejas.
- En la industria química: Es fundamental para fabricar otros productos, como el acetato de vinilo y el acetato de celulosa. Estos se usan para hacer materiales como el nailon, el rayón y el celofán.
- En la medicina:
* Se utiliza en colposcopias para ayudar a identificar ciertas condiciones en el cuello uterino. Cuando se aplica, algunos tejidos pueden cambiar de color, lo que ayuda a los médicos a ver áreas específicas. * Mezclado con alcohol, puede ayudar a prevenir infecciones de oído externas.
- En fotografía y radiología: Se usaba en una solución muy diluida para detener el proceso de revelado de fotografías en blanco y negro y placas radiológicas.
- En la limpieza: Es un ingrediente común en productos de limpieza y se usa para quitar manchas.
- En la cocina: Su uso más conocido es como vinagre, que se añade a muchos alimentos para darles sabor.
Seguridad al usar ácido acético
El ácido acético concentrado es una sustancia que debe manejarse con mucho cuidado. Puede causar quemaduras en la piel, daños graves en los ojos e irritación en las vías respiratorias. A veces, las quemaduras no aparecen de inmediato, sino horas después de la exposición.
Es importante usar guantes especiales, como los de goma de nitrilo, ya que los guantes de látex no ofrecen protección suficiente.
El ácido acético concentrado no se enciende fácilmente en un laboratorio. Sin embargo, si la temperatura ambiente supera los 39 °C, puede ser inflamable y formar mezclas explosivas con el aire.
Los peligros de las soluciones de ácido acético dependen de su concentración:
- Las soluciones con 10% a 25% de ácido acético son irritantes.
- Las soluciones con más del 25% son corrosivas, lo que significa que pueden causar daños graves.
Las soluciones con más del 25% de ácido acético deben manejarse en un lugar con buena ventilación, como una campana de extracción de humos, debido a sus vapores fuertes y corrosivos.
El ácido acético diluido, como el vinagre, es seguro para el consumo. Sin embargo, beber soluciones concentradas es muy peligroso y puede causar daños graves al sistema digestivo y afectar la acidez de la sangre.
Es importante guardar el ácido acético lejos de otras sustancias químicas como el ácido crómico o el ácido nítrico, ya que pueden reaccionar de forma peligrosa.
Véase también
 En inglés: Acetic acid Facts for Kids
En inglés: Acetic acid Facts for Kids