Etileno para niños
Datos para niños
Etileno |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Eteno | ||
| General | ||
| Fórmula semidesarrollada | CH2=CH2 | |
| Fórmula molecular | C2H4 | |
| Identificadores | ||
| Número CAS | 74-85-1 | |
| Número RTECS | KU5340000 | |
| ChEBI | 18153 | |
| ChEMBL | CHEMBL117822 | |
| ChemSpider | 6085 | |
| PubChem | 6325 | |
| UNII | 91GW059KN7 | |
| KEGG | C06547 | |
|
InChI
InChI=InChI=1S/C2H4/c1-2/h1-2H2
Key: VGGSQFUCUMXWEO-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1,178 kg/m³; 0,001178 g/cm³ | |
| Masa molar | 28,05 g/mol | |
| Punto de fusión | 104 K (−169 °C) | |
| Punto de ebullición | 169,5 K (−104 °C) | |
| Temperatura crítica | 282,9 K (10 °C) | |
| Presión crítica | 50,7 atm | |
| Propiedades químicas | ||
| Acidez | 44 pKa | |
| Solubilidad en agua | Miscible | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0gas | +52.47 kJ/mol | |
| ΔfH0líquido | n/d kJ/mol | |
| S0líquido, 1 bar | n/d J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
4
1
2
|
|
| Límites de explosividad | 2.7 - 36.0% | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El etileno o eteno es un compuesto químico orgánico. Está formado por dos átomos de carbono unidos por un doble enlace. También tiene cuatro átomos de hidrógeno. Su fórmula es C
2H
4.
Es uno de los productos químicos más importantes en la industria química. De hecho, es el compuesto orgánico más usado en el mundo. Casi el 60% de su producción se usa para hacer polietileno. El etileno es un gas sin color, inflamable y con un ligero olor dulce. Es el alqueno más sencillo, un tipo de hidrocarburo con un doble enlace entre carbonos.
El etileno se usa mucho en la industria química. En 2016, se produjeron más de 150 millones de toneladas. Gran parte de esto se convierte en polietileno. El polietileno es un plástico muy común que se usa para hacer muchas cosas. El etileno también es una hormona vegetal natural importante. Se usa en la agricultura para ayudar a las frutas a madurar.
Contenido
Estructura y propiedades del etileno
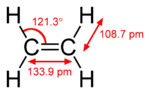
Este hidrocarburo tiene cuatro átomos de hidrógeno unidos a dos átomos de carbono. Estos carbonos están conectados por un doble enlace. La molécula no puede girar libremente alrededor de este doble enlace. Todos los átomos de etileno están en el mismo plano.
El ángulo entre los átomos de hidrógeno y carbono (H-C-H) es de 117.4 grados. Esto es muy parecido a los 120 grados que se esperan en un carbono con hibridación sp². El doble enlace en el etileno es lo que lo hace tan reactivo. Esta parte de la molécula tiene muchos electrónes. Por eso, otras sustancias pueden reaccionar fácilmente con ella.
¿Para qué se usa el etileno?
El etileno se usa en muchas reacciones industriales importantes. Las principales son:
- Polimerización (para hacer plásticos)
- Oxidación (para añadir oxígeno)
- Halogenación (para añadir halógenos como el cloro)
- Alquilación (para añadir grupos alquilo)
- Hidratación (para añadir agua)
- Oligomerización (para hacer cadenas cortas de polímeros)
- Hidroformilación (para añadir un grupo formilo)
En Estados Unidos y Europa, casi el 90% del etileno se usa para producir óxido de etileno, dicloruro de etileno, etilbenceno y polietileno.
Polimerización: El plástico más común
La polimerización consume más de la mitad del etileno que se produce en el mundo. Con este proceso se fabrica el polietileno. El polietileno es el plástico más usado. Se utiliza para hacer películas de embalaje y bolsas de basura.
También se producen alfa-olefinas lineales. Estas se usan para hacer detergentes, plastificantes y lubricantes sintéticos.
Oxidación: Creando otros compuestos
El etileno se oxida para producir óxido de etileno. Este es un material clave para fabricar tensoactivos y detergentes. El óxido de etileno también se usa para producir etilenglicol. El etilenglicol es un anticongelante común en los coches.
El etileno también puede oxidarse para producir acetaldehído. Este es un proceso industrial muy importante.
Halogenación: Derivados con halógenos
Al añadir halógenos al etileno, se obtienen productos como el dicloruro de etileno y el cloruro de etilo. Estos se usan para fabricar cloruro de polivinilo (PVC), que es un plástico muy conocido. También se usan para hacer tricloroetileno y percloroetileno.
Alquilación: Base para el estireno
El etilbenceno es un producto importante que se obtiene al añadir un grupo alquilo al etileno. El etilbenceno es el punto de partida para fabricar estireno. El estireno se usa principalmente para hacer poliestireno. Este plástico se utiliza en envases y aislantes. También se usa en el caucho estireno-butadieno para neumáticos y calzado.
¿Cómo reacciona el etileno?
El doble enlace del etileno tiene muchos electrónes. Por eso, puede reaccionar fácilmente con sustancias que necesitan electrones. A estas reacciones se les llama reacciones de adición. Así se pueden crear derivados con halógenos.
También se le puede añadir agua (reacción de hidratación) para obtener etanol. Para esto, se usa un catalizador como el ácido sulfúrico. Esta reacción puede ir en ambos sentidos.
Si se usa un catalizador metálico (como platino o níquel) y altas presiones, el etileno puede reaccionar con hidrógeno para formar etano.
¿Cómo se produce el etileno?
En 2016, se produjeron más de 150 millones de toneladas de etileno en todo el mundo.
La mayor parte del etileno se obtiene mediante un proceso llamado steam cracking (ruptura con vapor). En este proceso, se calientan hidrocarburos ligeros (como etano o propano) a temperaturas muy altas (750–950 °C). Este calor rompe los enlaces de los hidrocarburos y forma etileno. También se pueden obtener otros productos secundarios que luego se separan.
El etileno también se puede obtener de otras maneras, como el reformado catalítico de naftas o a partir de gas natural. En los laboratorios, se puede producir etileno quitando agua a los alcoholes.
El etileno como hormona vegetal
El etileno es una fitohormona. Esto significa que es una sustancia natural que ayuda a las plantas a crecer y desarrollarse. Es muy importante en procesos como:
- La maduración de las frutas.
- El envejecimiento de las hojas y flores.
- La caída de las frutas.
Existe una frase popular que dice: "una manzana podrida echa a perder el cesto". Esto se debe al etileno. Cuando una fruta madura, libera etileno. Este gas acelera la maduración de las frutas que están cerca. Por eso, a veces se usa etileno de forma artificial para madurar frutas que se cosecharon verdes. También se usa para intensificar el color rojo de los tomates.
El etileno que liberan las manzanas también puede hacer que las zanahorias se vuelvan amargas. Por eso, no es buena idea guardarlas juntas. Las plantas tienen "sensores" especiales que detectan el etileno.
¿Cómo se forma el etileno en las plantas?
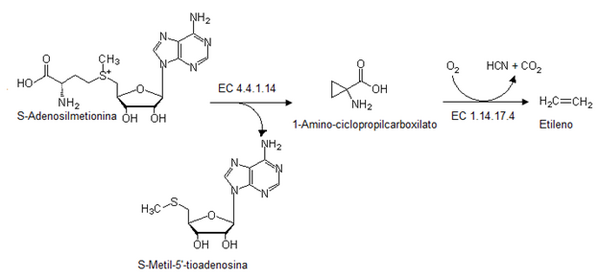
El etileno se forma en las plantas a partir de una sustancia llamada S-Adenosil metionina (SAM). Esta sustancia se transforma en un compuesto intermedio. Luego, este compuesto se oxida con oxígeno y una enzima especial. Al final, se produce etileno, junto con ácido cianhídrico y dióxido de carbono.
Historia del etileno
Algunos expertos creen que el famoso oráculo de Delfos en la antigua Grecia entraba en trance por el etileno que salía de las grietas del suelo.
El etileno fue descubierto por Johann Joachim Becher en 1669. Lo obtuvo calentando etanol con ácido sulfúrico. Más tarde, en 1777, Jan Ingenhousz también lo produjo.
En 1795, cuatro químicos holandeses (Johann Rudolph Deimann, Adrien Paets van Troostwyck, Anthoni Lauwerenburgh y Nicolas Bondt) estudiaron sus propiedades. Descubrieron que era diferente del hidrógeno y que contenía carbono e hidrógeno. También vieron que el etileno podía combinarse con el cloro para formar una sustancia aceitosa. Por eso, al etileno se le llamó "gas olefiante", que significa "gas para hacer aceite". De ahí viene la palabra moderna "olefina", que es la familia de hidrocarburos a la que pertenece el etileno.
A mediados del siglo XIX, el nombre "etileno" se usaba para referirse a una molécula con un átomo de hidrógeno menos que otra. En 1866, el químico alemán August Wilhelm von Hofmann propuso un sistema para nombrar los hidrocarburos. En su sistema, el etileno debería llamarse "eteno". Este sistema se convirtió en la base de la nomenclatura actual de la IUPAC. Sin embargo, el nombre "etileno" ya era muy popular y se sigue usando mucho hoy en día, especialmente en la industria.
El etileno se usó como anestésico en la década de 1920, después de experimentos en la Universidad de Chicago. Se siguió usando hasta los años 40. Sin embargo, su olor fuerte y su facilidad para explotar limitaron su uso.
Véase también
 En inglés: Ethylene Facts for Kids
En inglés: Ethylene Facts for Kids