Hipoclorito para niños
El ion hipoclorito es una partícula muy pequeña formada por un átomo de cloro y un átomo de oxígeno. Su fórmula química es ClO−. También se le conoce como monoxoclorato (I) o monoxoclorato (1-).
Un hipoclorito es un compuesto químico que contiene este ion. Son sales que vienen del ácido hipocloroso. Algunos ejemplos que quizás conozcas son el hipoclorito de sodio, que es el ingrediente principal de la lejía o lavandina, y el hipoclorito de calcio, que se usa en lejía en polvo.
Los hipocloritos no son muy estables. Por ejemplo, el hipoclorito de sodio no se puede encontrar en forma sólida porque, si se le quita el agua, se transforma en una mezcla de cloruro de sodio y clorato de sodio. Si se calienta una solución de hipoclorito de sodio, también ocurre esta transformación. Además, la luz del sol puede descomponer el hipoclorito, convirtiéndolo en cloruros y oxígeno.
Como no son muy estables, los hipocloritos son agentes oxidantes muy fuertes. Esto significa que pueden reaccionar con muchas sustancias, tanto orgánicas (como las que se encuentran en los seres vivos) como inorgánicas (como los minerales).
Las reacciones con compuestos orgánicos pueden generar mucho calor y, en algunos casos, fuego, por lo que es importante manejar los hipocloritos con cuidado.
Contenido
¿Cómo se preparan los hipocloritos?
Fabricación del hipoclorito de sodio
El hipoclorito de sodio (NaClO), que es el componente principal de la lejía, se puede fabricar de varias maneras. Una forma es haciendo burbujear gas cloro a través de una solución diluida de hidróxido de sodio a temperatura ambiente.
La reacción química es la siguiente: 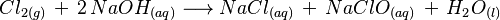 Esto significa que el gas cloro (Cl₂) reacciona con el hidróxido de sodio (NaOH) disuelto en agua para formar cloruro de sodio (NaCl), hipoclorito de sodio (NaClO) y agua (H₂O).
Esto significa que el gas cloro (Cl₂) reacciona con el hidróxido de sodio (NaOH) disuelto en agua para formar cloruro de sodio (NaCl), hipoclorito de sodio (NaClO) y agua (H₂O).
También se puede producir hipoclorito de sodio mediante un proceso llamado electrólisis. En este método, se pasa electricidad a través de una solución de cloruro de sodio (sal común) sin separar los productos que se forman en los electrodos.
Reacciones con hidróxido de sodio concentrado
Si el cloro reacciona con hidróxido de sodio concentrado y caliente, se forman otros tipos de aniones de cloro con un estado de oxidación mayor: 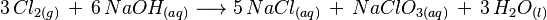 En esta reacción, el cloro (Cl₂) y el hidróxido de sodio (NaOH) producen cloruro de sodio (NaCl), clorato de sodio (NaClO₃) y agua (H₂O).
En esta reacción, el cloro (Cl₂) y el hidróxido de sodio (NaOH) producen cloruro de sodio (NaCl), clorato de sodio (NaClO₃) y agua (H₂O).
Usos y propiedades químicas de los hipocloritos
Reacción con ácidos: ¡Cuidado!
Los hipocloritos, como la lejía, producen gas cloro cuando se mezclan con ácidos diluidos. Por eso, es muy importante no mezclar lejía con productos de limpieza que contengan ácido, como el ácido clorhídrico (conocido como "agua fuerte").
La reacción es la siguiente:
- 2 H+ (aq) + ClO- (aq) + Cl- (aq)
 Cl2 (g) + H2O (l)
Cl2 (g) + H2O (l)
Esto significa que los iones de hidrógeno (H⁺), los iones hipoclorito (ClO⁻) y los iones cloruro (Cl⁻) pueden formar gas cloro (Cl₂) y agua (H₂O). Si hay muchos iones de hidrógeno (lo que significa un pH bajo, es decir, un ácido), se libera más gas cloro. Este gas puede ser peligroso si se inhala.
Acción blanqueante: ¿Cómo quitan las manchas?
Los hipocloritos, especialmente el hipoclorito de sodio y el hipoclorito de calcio, se usan mucho en casa y en la industria para blanquear. Sirven para quitar el color de la ropa, aclarar el cabello y eliminar manchas. Esta propiedad fue descubierta en 1785 por el químico francés Claude Berthollet.
Acción desinfectante: Limpieza profunda
Los hipocloritos también son muy usados como desinfectantes y desodorantes. Pueden eliminar muchos tipos de gérmenes y malos olores. Esta aplicación se descubrió alrededor de 1820 por el químico francés Antoine Germain Labarraque, incluso antes de que Louis Pasteur explicara su teoría de los gérmenes como causa de las enfermedades.
Como agente oxidante: Transformando sustancias
Los hipocloritos son los agentes oxidantes más fuertes entre los oxoaniones de cloro. Esto significa que tienen una gran capacidad para quitar electrones a otras sustancias, transformándolas. Por ejemplo, pueden oxidar el ion manganeso (Mn²⁺) y convertirlo en permanganato (MnO₄⁻):
- 2 Mn2+ + 5 ClO- + 6 OH- → 2 MnO4- + 3 H2O + 5 Cl-
Estabilidad de los hipocloritos
Los hipocloritos son los oxoaniones de cloro menos estables. Muchos de ellos solo existen cuando están disueltos en agua y no se pueden encontrar en su forma pura. Esto también le ocurre al propio ácido hipocloroso (HClO).
Los hipocloritos pueden sufrir reacciones de descomposición. Cuando se calienta un hipoclorito, se descompone en una mezcla de cloruro, oxígeno y otros oxoaniones de cloro, como el clorato o el clorito.
Por ejemplo, dos formas en que el ion hipoclorito puede descomponerse son:
- 2 ClO- (aq) → 2 Cl- (aq) + O2 (aq)
- 3 ClO- (aq) → 2 Cl- (aq) + ClO3- (aq)
Otros iones de cloro relacionados
En química, los nombres de los iones de cloro a menudo indican el estado de oxidación del cloro. El estado de oxidación es un número que nos dice cuántos electrones ha ganado o perdido un átomo en un compuesto.
Aquí tienes una tabla con algunos de los iones de cloro más comunes:
| Nombre común | Nombre sistemático | Estado de oxidación | Fórmula |
|---|---|---|---|
| Hipoclorito | Monoxoclorato(I) | +1 | ClO− |
| Clorito | Dioxoclorato(III) | +3 | ClO2− |
| Clorato | Trioxoclorato(V) | +5 | ClO3− |
| Perclorato | Tetraoxoclorato(VII) | +7 | ClO4− |
Cuando se habla de "clorato" sin especificar, generalmente se refiere al ion con estado de oxidación +5, porque es el más común en la nomenclatura tradicional.
Véase también
 En inglés: Hypochlorite Facts for Kids
En inglés: Hypochlorite Facts for Kids