Virus de la inmunodeficiencia humana para niños
Datos para niños Virus de la inmunodeficiencia humana (VIH) |
||
|---|---|---|
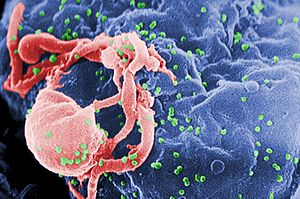 Micrografía electrónica de barrido del VIH-1 (en verde) brotando de un linfocito cultivado. Múltiples protuberancias redondas en la superficie celular representan los lugares de ensamblaje y gemación de los viriones.
|
||
| Taxonomía | ||
| Dominio: | Riboviria | |
| Reino: | Pararnavirae | |
| Orden: | Ortervirales | |
| Familia: | Retroviridae | |
| Género: | Lentivirus | |
| Clasificación de Baltimore | ||
| Grupo: | VI (Virus ARN monocatenario retrotranscrito) | |
| Especies | ||
|
||
El virus de la inmunodeficiencia humana (VIH) es un tipo de lentivirus. Este virus pertenece a la familia de los retrovirus y es el causante de la infección por VIH. Con el tiempo, esta infección puede llevar al desarrollo del síndrome de inmunodeficiencia adquirida (sida). El sida es una enfermedad que debilita el sistema inmune del cuerpo. Esto hace que las personas sean más vulnerables a infecciones oportunistas y cánceres que pueden ser muy peligrosos.
Sin tratamiento, la vida promedio después de la infección por VIH es de unos nueve a once años. La infección por VIH solo se transmite a través de ciertos fluidos corporales de personas infectadas. Dentro de estos fluidos, el VIH se encuentra como partículas libres o dentro de células inmunes infectadas.
El VIH ataca células muy importantes del sistema inmune, como las células T helper (específicamente, las células CD4+), los macrófagos y las células dendríticas. La infección por VIH puede reducir el número de células T CD4+. Esto ocurre por diferentes razones, como la muerte de células T infectadas o no infectadas, y la destrucción de células T CD4+ por otras células de defensa. Cuando el número de células T CD4+ baja mucho, el cuerpo pierde su capacidad de defenderse. Así, la persona se vuelve más propensa a infecciones oportunistas asociadas al VIH.
Cuando una persona tiene VIH y su pareja no, se les llama pareja serodiscordante.
Contenido
- ¿Qué es el VIH y cómo se clasifica?
- ¿Cómo es la estructura del VIH?
- ¿Cómo se reproduce el VIH?
- ¿Cómo evoluciona la infección por VIH?
- ¿Cómo afecta el VIH al sistema inmune?
- ¿De dónde viene el VIH?
- ¿Cómo se extiende el VIH en el mundo?
- VIH en adultos mayores
- ¿Qué medicamentos existen contra el VIH?
- ¿Cómo se detecta el VIH?
- ¿Hay una vacuna contra el VIH?
- Véase también
¿Qué es el VIH y cómo se clasifica?
El virus de la inmunodeficiencia humana es parte del género Lentivirus. Este grupo pertenece a la familia Retroviridae. Los virus de este grupo tienen características similares en su forma y biología. Muchos animales pueden ser afectados por lentivirus. Una característica principal de estos virus es que tardan mucho tiempo en causar una enfermedad, a veces varios años.
| Familia | Subfamilia | Género | Ejemplos |
|
Retroviridae |
Orthoretrovirinae |
Retrovirus α | Virus del sarcoma de Rous |
| Retrovirus β | Virus del tumor mamario de ratón | ||
| Retrovirus γ | Virus de la leucemia de felinos | ||
| Retrovirus δ | Virus linfotrópico humano de células T (VLTH-1/2) | ||
| Retrovirus ε | Virus del sarcoma dérmico de Wally | ||
| Lentivirus | Virus de la inmunodeficiencia humana (VIH-1/2)
Virus de la inmunodeficiencia simia (VIS). |
||
| Spumaretrovirinae | Espumavirus | Espumavirus humano |
El VIH fue descubierto en 1983 en Francia por el equipo de Luc Montagnier. Se le consideró el causante de la nueva epidemia de sida. El virus tiene forma esférica, está cubierto por una envoltura y tiene una capa protectora de proteínas. Su información genética es una cadena de ARN. Para multiplicarse e integrarse en la célula que infecta, el ARN debe copiarse primero a ADN. Las proteínas de la envoltura exterior del virus se unen a proteínas específicas en la membrana de las células que puede infectar, especialmente los linfocitos T CD4.
Cuando el virus entra en una célula, su ARN se convierte en una doble cadena de ADN. Esto lo hace una enzima del virus llamada transcriptasa inversa. Luego, otra enzima, la integrasa, ayuda a que el ADN del virus se una al ADN de la célula. Así, la célula queda infectada. Después de esto, el virus puede quedarse "dormido" (en latencia) o empezar a multiplicarse activamente. Si se multiplica, libera nuevas partículas de virus que pueden infectar otras células.
Existen dos tipos de VIH: VIH-1 y VIH-2. El VIH-1 fue el primero en descubrirse y es el que causa la mayoría de las infecciones por VIH en el mundo. Es más fuerte y se transmite más fácilmente que el VIH-2. El VIH-2 es menos contagioso y se encuentra casi solo en países de África occidental.
¿Cómo es la estructura del VIH?
Partes del virus
El VIH tiene las características principales de los retrovirus. El virus contiene su información genética en forma de ARN. Este ARN está protegido por una capa de membrana. Los retrovirus introducen su información genética en las células que infectan gracias a la transcriptasa inversa.
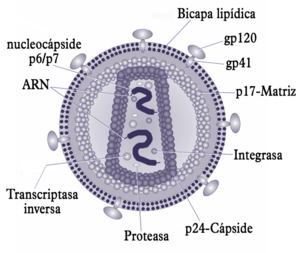
Un virus del VIH tiene una forma casi redonda, con un tamaño de 80 a 100 nm. Está formado por tres capas. La capa exterior es una doble capa de lípidos. Tiene 72 "púas" hechas de glicoproteínas llamadas gp120 y gp41. Estas púas ayudan al virus a unirse a la célula que va a infectar. La capa del medio es una cápside con forma de icosaedro. La capa interior tiene forma de cono. Contiene el ARN del virus y una nucleoproteína. La información genética del VIH es una cadena simple de ARN, compuesta por dos hilos idénticos. El ARN contiene varios genes. Cada gen da las instrucciones para crear las proteínas que el VIH necesita para reproducirse.
Información genética y composición
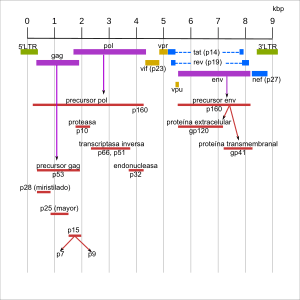
Los genes del VIH-1 y VIH-2 son muy parecidos. Ambos tienen los tres genes básicos de los retrovirus: gag, pol y env. Cada uno de estos genes produce proteínas que ayudan al virus a reproducirse. El VIH también tiene otros seis genes: tat, vpr, rev, vpu (o vpx en el VIH-2), vif y nef.
Genes estructurales
Los genes gag, pol y env producen las proteínas que forman la estructura del virus. Estas proteínas ocupan la mayor parte del genoma viral.
El gen gag se convierte en una proteína precursora, la p55. Esta proteína se une al ARN del virus y a otras proteínas para formar nuevas partículas virales. Una proteasa, que viene del gen pol, corta la p55 en cuatro proteínas que se colocan en sus lugares:
- La proteína p24 forma la cápside (la capa protectora).
- La proteína p17 forma la matriz, que está debajo de la envoltura y la estabiliza.
- Las proteínas p6 y p7 (o p9) forman la nucleocápside.
Dentro de la cápside, además de las dos copias idénticas del ARN viral, hay tres enzimas esenciales para que el virus se multiplique: una transcriptasa inversa, una integrasa y una proteasa. Estas enzimas se forman a partir de la proteína Pol. La proteasa del virus corta esta proteína para obtener las proteínas Gag y Pol. Luego, la proteína Pol se corta para formar cuatro proteínas funcionales:
- La proteasa (p10): Corta las proteínas Gag, Pol y Gag-Pol. Algunos medicamentos contra el VIH bloquean su función.
- La transcriptasa inversa (p50): Crea una doble cadena de ADN a partir del ARN del virus. También hay muchos medicamentos que actúan contra esta enzima.
- La ARNasa (p15): Separa las cadenas de ARN de las de ADN durante la copia.
- La integrasa (p31): Inserta el ADN del virus en el ADN de la célula que infecta. Existen medicamentos que bloquean la actividad de la integrasa.
La envoltura del virus es una doble capa de lípidos que viene de la membrana de la célula infectada. Esta envoltura tiene 72 "púas" que son complejos de proteínas virales (gp41 y gp120). La gp120 es clave para que el virus se una a la célula antes de invadirla. Las proteínas gp41 y gp120 se forman como una sola proteína (gp160) antes de ser cortadas.
Los medicamentos llamados inhibidores de la fusión actúan contra la proteína gp41 para evitar que el virus se una a los linfocitos.
Proteínas reguladoras
Tat
La proteína Tat existe en dos formas. Es muy importante para que el virus produzca nuevas partículas. La proteína Tat se une a una parte del ARN del virus y ayuda a que se copie el resto de la cadena.
Rev
La proteína rev controla cómo se expresa el ARN del virus, regulando la salida del ARNm de la célula.
Tat y Rev: acción conjunta
Las proteínas Tat y Rev trabajan juntas para aumentar mucho la producción de proteínas virales. Son esenciales para el ciclo de vida del VIH. Sus funciones facilitan la producción de proteínas virales en dos pasos. Primero, se producen Tat, Rev y Nef. Luego, Tat y Rev van al núcleo para aumentar la copia del ADN del virus y el transporte de todo el ARNm viral. Esto permite que se produzcan otras proteínas del virus. Aunque otras proteínas como Vif, Vpr, Vpu y Nef no son esenciales en laboratorio, su presencia en el virus sugiere que son importantes en el cuerpo humano.
Proteínas accesorias
Vif: aumenta la capacidad de infección y protege el genoma viral
Vif es una proteína que se encuentra en pequeñas cantidades dentro del virus. Interactúa con el ARN genético del virus. Si esta proteína no funciona, el VIH-1 es menos capaz de infectar. Vif es necesaria para bloquear la acción de una proteína llamada ApoBEC3G. Esta proteína puede dañar el ADN del virus, pero el VIH ha desarrollado una estrategia para evitarlo.
Vpu: facilita la liberación de virus de las células infectadas
Vpu es una proteína que se inserta en las membranas de las células. Es única del VIH-1. Se cree que Vpu tiene dos funciones:
Degradación de la proteína CD4
Sin Vpu, la proteína CD4 de la célula se une a una proteína del virus (gp160) y forma un complejo que retiene la gp120 dentro de la célula. Vpu se une a CD4 y a otra proteína, lo que hace que CD4 se degrade. Esto permite que más gp120 se muestre en la superficie de la célula.
Mejora la liberación de virus de la membrana celular
Esta función depende de una parte de Vpu que está en la membrana. Sin Vpu, los virus se quedan pegados a la superficie de la célula. La presencia de Vpu ayuda a que los virus se liberen más fácilmente. Este efecto no es solo para el VIH-1, sino también para otros virus. No se sabe exactamente cómo funciona, pero se sugiere que Vpu ayuda a que la membrana de la célula sea más fluida o que interrumpe las uniones entre las proteínas del VIH y la superficie de la célula.
¿Cómo se reproduce el VIH?
El VIH ataca principalmente los linfocitos T CD4+, pero también puede infectar otras células como monocitos/macrófagos y células dendríticas. El virus se reproduce en diferentes partes del cuerpo, como los ganglios linfáticos, el intestino y el cerebro. Los órganos linfoides, especialmente los ganglios, son los lugares principales donde se multiplica. El virus se encuentra en muchos fluidos del cuerpo, como la sangre.
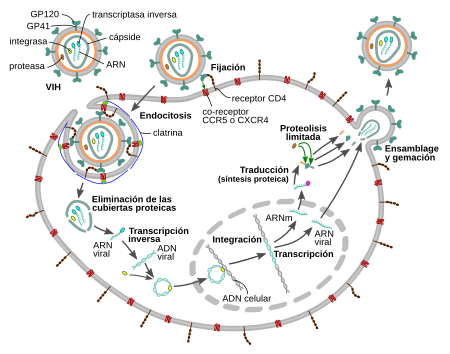
La reproducción del virus ocurre en varias etapas:
- La unión: Es el primer paso. El virus se une a la célula que va a infectar. Esto sucede cuando las proteínas de la envoltura del virus (gp120 y gp41) se unen a los receptores de la célula (CD4 y correceptores como CCR5 o CXCR4). Esta unión es necesaria para que el virus pueda entrar en la célula.
- La entrada: Una vez que el virus se ha unido, su envoltura se fusiona con la membrana de la célula. Así, el contenido del virus (ARN y proteínas) entra en el citoplasma de la célula. Luego, las capas protectoras del virus se eliminan, dejando el ARN viral libre.
- La copia del ARN viral a ADN: Cada molécula de ARN del virus viene con una enzima llamada transcriptasa inversa. Esta enzima copia el ARN viral a una molécula de ADN. Las dos moléculas de ADN se unen para formar una sola molécula de ADN.
- Integración del ADN viral en el ADN de la célula: El ADN del virus entra en el núcleo de la célula y se inserta en el ADN de la célula huésped. Esto lo hace una enzima llamada integrasa, que también viene del virus.
- La copia del ADN viral por la célula: La célula usa sus propios mecanismos para copiar el ADN viral y crear un ARNm (ARN mensajero). Este ARNm es procesado y luego sale del núcleo al citoplasma.
La copia del ADN viral depende de la activación de los linfocitos T CD4 infectados.
- Producción de proteínas: Una vez en el citoplasma, el ARNm da las instrucciones para que la célula fabrique las proteínas del virus. Estas proteínas no son funcionales de inmediato, sino que son "cortadas" en fragmentos por enzimas específicas del VIH. Las proteínas virales se unen con el ARN viral para formar las partes internas del nuevo virus.
- Gemación: Es el último paso. Las nuevas partículas del virus se acercan a la membrana de la célula, se envuelven en ella y se desprenden, formando un nuevo virus capaz de infectar. En cada célula infectada se forman miles de nuevos virus, aunque muchos no son completos y no pueden infectar.
¿Cómo evoluciona la infección por VIH?
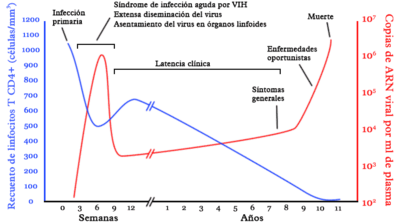
La infección por VIH tiene varias etapas, cada una con sus propios síntomas y señales. Si no se trata, el virus se multiplica constantemente y ataca los linfocitos T-CD4. Estas células son una parte clave del sistema inmunológico. El cuerpo intenta defenderse, pero con el tiempo, el VIH se vuelve más fuerte y destruye el sistema inmune. Esto deja a la persona seropositiva expuesta a muchas enfermedades oportunistas que pueden ser mortales.
El estado de la enfermedad y el efecto del tratamiento se miden con dos cosas:
- El número de linfocitos T CD4 por mililitro de sangre.
- La cantidad de virus en la sangre (carga viral).
Fase inicial
La fase inicial de la infección por VIH comienza en el momento de la infección. El virus se extiende por el cuerpo a través de los fluidos corporales. En pocos días, el VIH infecta las células expuestas y los ganglios linfáticos. Durante este tiempo, el virus se multiplica mucho. El tejido linfoide del intestino es uno de los primeros lugares donde el VIH se reproduce, debido a la gran cantidad de linfocitos T CD4 que hay allí.
Muchas personas que se infectan no tienen síntomas en esta fase inicial. Son pacientes asintomáticos. Sin embargo, se calcula que entre el 40% y el 90% de los casos de infección por VIH-1 sí presentan síntomas. Estos síntomas son parecidos a los de una mononucleosis infecciosa: fiebre, dolores musculares, ganglios inflamados, sudoración nocturna, diarrea, náuseas y vómito. La mayoría de las personas no son diagnosticadas en esta fase porque los síntomas son comunes a muchas enfermedades. Si crees que pudiste haber estado expuesto y tienes estos síntomas, es bueno que consultes a un médico. Los síntomas de la fase inicial aparecen entre cinco y diez semanas después de la exposición y desaparecen en pocos días.
El VIH ataca principalmente los linfocitos T CD4+, que son parte del sistema inmune. Aunque estas células no atacan directamente a los invasores, son muy importantes para la respuesta de defensa del cuerpo. En una persona sana, hay entre 500 y 1200 linfocitos T CD4+ por microlitro. Durante la fase sin síntomas, la proporción de linfocitos infectados es baja, pero aumenta con el tiempo. En la fase inicial, las pruebas tradicionales suelen dar negativo porque detectan anticuerpos, que tardan en aparecer (unas 12 semanas). Sin embargo, las pruebas de carga viral, que cuentan el número de copias del ARN del virus en la sangre, mostrarán una cantidad alta de virus en esta fase.
Fase crónica
Después de los síntomas iniciales, sigue una etapa llamada latencia clínica, VIH asintomático o VIH crónico. Sin tratamiento, esta etapa puede durar desde unos tres años hasta más de 20 años (en promedio, unos ocho años). A las personas que no desarrollan la enfermedad rápidamente se les llama "no progresores a largo plazo".
Aunque al principio hay pocos o ningún síntoma, hacia el final de esta etapa muchas personas pueden tener fiebre, pérdida de peso, problemas digestivos y dolores musculares. Entre el 50% y el 70% también desarrollan ganglios linfáticos inflamados de forma persistente.
La mayoría de las personas con VIH-1 tienen una cantidad detectable de virus y, sin tratamiento, avanzarán hacia el sida. Sin embargo, un pequeño grupo (alrededor del 5%) mantiene altos niveles de linfocitos T CD4+ sin tratamiento antirretroviral por más de cinco años. A estos se les llama "controladores del VIH". Otro grupo, los "controladores de élite", mantienen una carga viral baja o indetectable sin tratamiento. Son aproximadamente 1 de cada 300 personas infectadas.
Síndrome de inmunodeficiencia adquirida
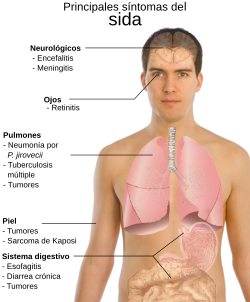
El sida es la etapa más avanzada de la infección por VIH. En esta fase, el sistema inmune de la persona ya no puede reponer los linfocitos T CD4+ que pierde. También ha disminuido su capacidad para atacar al virus. Esto coincide con un aumento en la multiplicación del virus, lo que debilita la capacidad del cuerpo para defenderse de otras enfermedades. Así, la persona es vulnerable a muchas infecciones oportunistas que pueden ser mortales. La neumonía por P. jiroveci, el sarcoma de Kaposi, la tuberculosis, la candidiasis y la infección por citomegalovirus son algunas de las infecciones más comunes en personas con sida.
La mayoría de los pacientes con sida no sobreviven más de tres años sin tratamiento antirretroviral. Sin embargo, incluso en esta etapa avanzada, el sida y el VIH pueden controlarse con la terapia antirretroviral de gran actividad. Los antirretrovirales mejoran la calidad de vida de las personas con VIH y aumentan sus posibilidades de supervivencia. Gracias a estos tratamientos, la enfermedad ha pasado de ser mortal a ser una condición crónica.
Los medicamentos antirretrovirales no eliminan el virus de los "reservorios" donde permanece oculto. Pero sí logran reducir la cantidad de virus en la sangre a niveles indetectables (Carga viral indetectable (VIH)), lo que impide su transmisión a otras personas.
La OMS (Organización Mundial de la Salud) ha clasificado a las personas con VIH en 9 categorías. Esto se basa en el número de linfocitos T CD4 por mililitro de sangre y la etapa de la infección:
- Categoría A: pacientes en la fase inicial de la infección.
- Categoría B: pacientes en la fase crónica de la infección.
- Categoría C: pacientes en la fase final de la infección.
Solo las personas en las categorías azules tienen sida. Los demás pacientes se consideran solo infectados por VIH.
Enfermedades Oportunistas asociadas al VIH
Artículo principal: Enfermedades oportunistas
Cuando el número de linfocitos T CD4+ disminuye, aumenta el riesgo de desarrollar infecciones oportunistas.
| Tipo de Agente | Ejemplos comunes | CD4+ típico |
|---|---|---|
| Bacterias | Mycobacterium tuberculosis, MAC | <200, <50 |
| Virus | Citomegalovirus, HSV | <50 |
| Hongos | Pneumocystis jirovecci, Candida spp., Cryptococcus neoformans, Histoplasma capsulatum | <100-200 |
| Parásitos | Toxoplasma gondii, Cryptosporidium spp. | <50-100 |
| Neoplasias | Sarcoma de Kaposi, Linfoma de Burkitt, Linfoma no Hodgkin, Cáncer de cuello uterino | Variable |
¿Cómo afecta el VIH al sistema inmune?
La principal forma en que el VIH afecta al cuerpo es "agotando" el sistema inmune. Esto ocurre por la pérdida de linfocitos CD4. Los principales mecanismos de destrucción de estos linfocitos son:
- El virus ataca directamente a los linfocitos CD4, especialmente a los que están activos y tienen las características para que el virus se reproduzca dentro de ellos.
- El "efecto espectador inocente": La infección viral activa la respuesta de las células de defensa. En particular, hay un rápido aumento de los CD8 en la fase inicial. Estos CD8 atacan y destruyen los CD4 afectados.
- Activación constante del sistema inmune: La gran cantidad de virus en el cuerpo provoca una activación continua del sistema inmune. Esto libera sustancias que contribuyen a la muerte de las células y altera el funcionamiento de la respuesta, disminuyendo la capacidad de los linfocitos CD8 para atacar.
- Muerte celular programada: Se ha demostrado que partículas del VIH como gp120 o proteínas reguladoras como Vpr y Tat pueden causar la muerte programada de los linfocitos CD4 al interactuar con sus receptores.
¿De dónde viene el VIH?
Origen y evolución
Como otros agentes que causan enfermedades infecciosas emergentes, el VIH pasó a los humanos por zoonosis. Esto significa que se transmitió desde otras especies. El surgimiento del sida y la identificación del VIH impulsaron investigaciones que mostraron que las variantes del VIH son parte de un gran grupo de lentivirus. El VIH es muy similar a un virus que afecta a otros primates, llamado Virus de inmunodeficiencia en simios (SIV). Se conocen varias cepas de SIV que se transmiten de forma similar. A diferencia del VIH, el SIV no causa inmunodeficiencia en los animales que lo hospedan, a menos que salte de una especie a otra.
El VIH-1, que es el responsable de la pandemia actual, está muy relacionado con el SIVcpz. Este virus infecta a los chimpancés comunes (Pan troglodytes troglodytes) en África central. El SIVcpz, a su vez, parece haber surgido de la combinación de otros SIV de monos. Esta idea se apoya en que tanto el VIH como las cepas de SIV tienen el gen vpu. También se han reportado transmisiones de SIV entre humanos en África ecuatorial. Los chimpancés cazan monos pequeños para comer, lo que pudo facilitar que se infectaran con diferentes cepas de SIV.
El salto del virus de los chimpancés (P. t. troglodytes) a los humanos ocurrió al menos tres veces. Esto dio origen a variantes del VIH-1 que están relacionadas con diferentes cepas de SIVcpz. Por lo tanto, el VIH-1 es un virus con múltiples orígenes. El grupo M del VIH-1, que causó la pandemia actual, probablemente pasó a los humanos en la primera mitad del siglo XX. Los grupos O y N del VIH-1 se encuentran solo en África Occidental ecuatorial, y el grupo N solo en Camerún. Parece claro que el chimpancé Pan troglodytes troglodytes es el animal de donde el VIH-1 ha pasado repetidamente a los humanos.
Por otro lado, el VIH-2, que se encuentra en África Occidental, proviene del SIVsm. Este virus es propio de un tipo de mono llamado mangabeye fuliginoso (Cercocebus atys atys), que vive en las selvas costeras desde Senegal hasta Costa de Marfil. Los estudios genéticos muestran que este virus también pasó a los humanos varias veces.
Los SIV encontrados hasta ahora son específicos de ciertas especies y se cree que este grupo de virus se originó en África. La frecuencia de la infección varía entre especies y poblaciones, pero no supera el 30% en chimpancés afectados. En otros primates, como Cercocebus atys, puede superar el 50%.
En todos los casos conocidos, el virus parece estar en equilibrio con su huésped natural. Esto es probablemente el resultado de una larga coevolución. Generalmente, solo se observan formas muy leves del síndrome de inmunodeficiencia, como una pequeña reducción de linfocitos T CD4+. Esta reducción no suele poner en peligro la vida del animal. Sin embargo, en un caso de Cercocebus atys, se desarrolló un sida típico después de 18 años. Esto sugiere que la baja esperanza de vida de los monos, junto con un largo período de incubación, hace que la inmunodeficiencia sea un resultado raro en ellos.
Según un estudio de 2022 de la Universidad de Oxford publicado en la revista Science, se ha encontrado una nueva variante del VIH más contagiosa y dañina. Esta mutación, llamada VB, hace que el sistema inmunitario se debilite más rápido.
Descubrimiento

Desde 1981, se empezaron a detectar casos extraños de infección por Pneumocystis carinii (ahora llamado Pneumocystis jiroveci). Este hongo suele infectar a personas con sistemas inmunes muy débiles. Al principio, se observaron casos similares en hombres. Se pensó que la causa podría estar relacionada con prácticas comunes en esa población.
Pronto aparecieron casos que afectaban a hombres y mujeres que usaban sustancias inyectables, y a sus hijos. También se encontraron casos en personas que no tenían esos hábitos, pero que habían recibido transfusiones de sangre o productos sanguíneos, como los hemofílicos. Entonces se pensó que la causa debía ser un agente infeccioso que se transmitía de forma similar al virus de la hepatitis B.
Varios equipos comenzaron a buscar un virus relacionado con los casos de inmunodeficiencia adquirida. En 1983, en el Instituto Pasteur de París, un equipo liderado por J.C. Chermann, F. Barré-Sinoussi y L. Montagnier, encontró un posible virus. Lo llamaron virus asociado a la linfoadenopatía (LAV).
En 1984, el equipo de R. Gallo confirmó el descubrimiento, pero lo llamó virus linfotrópico T humano tipo III (HTLV-III). Hubo una disputa sobre quién lo descubrió primero. Finalmente, se acordó que el virus se llamaría virus de la inmunodeficiencia humana (HIV en inglés, VIH en español).
En el mismo año, 1983, en que se identificó el virus, varios equipos comenzaron a estudiar su información genética. En 1985, se publicó la secuencia de su genoma y se empezaron a identificar sus proteínas.
En 1985, se desarrolló la técnica ELISA para detectar el virus. También se descubrió un nuevo retrovirus en dos pacientes de Guinea-Bisáu y Cabo Verde, diferente al VIH-1. Esto llevó a investigar en África Occidental, donde se identificó el VIH-2.
En 1987, se estudió el genoma del VIH-2. Se confirmó que el VIH-2 provenía del VIS y que era diferente al VIH-1 en un 50% de su genoma. Además, el VIH-2 tenía un gen llamado vpx, mientras que el VIH-1 tenía el gen vpu.
¿Cómo se extiende el VIH en el mundo?
El VIH se ha convertido en una epidemia mundial. El Programa Conjunto de Naciones Unidas sobre el VIH/sida (Onusida) coordina los esfuerzos de científicos, gobiernos y organizaciones para combatir la epidemia. Onusida monitorea la situación del VIH en el mundo y publica informes cada dos años. Estos informes muestran cómo evoluciona la pandemia, sus efectos sociales y las estrategias para controlarla.
A nivel mundial, la forma más común de transmisión del VIH sigue siendo el contacto físico íntimo entre hombres y mujeres. Entre 1981 y 2007, el sida causó la muerte de aproximadamente 25 millones de personas en todo el mundo. En 2007, 33 millones de personas estaban infectadas con VIH. La epidemia se ha estabilizado, lo que significa que la proporción de personas infectadas no ha aumentado en relación con la población total. Además, se ha observado una reducción en el número total de nuevos casos de infección por VIH en el mundo.
La región más afectada por la pandemia es África subsahariana. Allí viven 21.5 millones de personas con VIH, lo que representa casi tres cuartas partes del total mundial. Esta región también tiene las tasas más altas de muertes por sida y el mayor número de nuevas infecciones.
VIH en adultos mayores
Históricamente, el VIH se consideraba una enfermedad de adultos jóvenes. Sin embargo, ahora se estima que aproximadamente el 25% de los pacientes con VIH en Estados Unidos tienen 50 años o más. Al principio de la epidemia, un pequeño pero importante grupo de adultos mayores se infectó por transfusiones de sangre. Después, esta tendencia cambió, y los hombres mayores se infectaron principalmente a través de contacto físico íntimo o, en menor medida, por el uso de sustancias inyectables.
Estudios con pacientes VIH-positivos mayores de 50 años, comparados con jóvenes, muestran que los pacientes de mayor edad tienen más probabilidades de tener complicaciones médicas y más limitaciones físicas.
La salud mental también es un factor importante. Tanto hombres como mujeres con VIH han mostrado malestar psicológico relacionado con las pruebas de infección. La mayoría de los estudios indican que las mujeres suelen reportar más síntomas psicológicos que los hombres.
Uno de los problemas para detectar el VIH en adultos mayores es que a veces sus respuestas no son muy claras. Esto puede llevar a suposiciones incorrectas sobre los comportamientos de riesgo.
¿Qué medicamentos existen contra el VIH?
Existen muchos medicamentos para prevenir la infección y detener la multiplicación del virus. Estos medicamentos se clasifican según la proteína del virus a la que atacan. A continuación, se muestran los diferentes tipos de medicamentos y el paso del ciclo de vida del virus que bloquean:
- Inhibidores de la unión o fusión: Impiden que el virus entre en la célula al bloquear su unión a los receptores de la superficie celular.
- Inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN): Detienen la multiplicación del virus al impedir la formación del ADN complementario. Estos medicamentos son reconocidos por la enzima como si fueran nucleósidos normales.
- Inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINAN): Bloquean la acción de la enzima por otros mecanismos, evitando también la reproducción del virus.
- Inhibidores de la proteasa: Impiden la producción de virus activos.
- Inhibidores de la integrasa: Evitan que el virus inserte su material genético en la célula.
- Inhibidores de la maduración del virus: Bloquean el proceso correcto de formación del virus, impidiendo que se organicen las partículas virales maduras.
Debido a que el virus puede desarrollar resistencia, se recomienda usar una combinación de medicamentos de diferentes grupos. Esto se llama TARGA (Terapia AntirRetroviral de Gran Actividad).
El AZT por sí solo no destruye el virus directamente. Lo que hace es bloquear la enzima transcriptasa inversa. Esto impide que el ARN del virus se copie a ADN y, por lo tanto, evita que se forme un provirus (el ADN que se integra en la célula huésped). Si se usa solo, sin combinarlo con otros medicamentos del TARGA, puede hacer que el virus mute y se vuelva más resistente y agresivo. Esto anularía su efecto y aceleraría la enfermedad. Este riesgo disminuye mucho cuando se combina con otros medicamentos. También se reduce su toxicidad al ajustar las dosis mínimas efectivas en combinación.
Todas las mujeres embarazadas con VIH deben tomar medicamentos contra el virus, sin importar el número de linfocitos T CD4 o la carga viral. El objetivo es reducir la carga viral a niveles indetectables y así evitar la transmisión del virus al bebé. Es importante saber que los tratamientos contra el VIH no aumentan el riesgo de defectos de nacimiento en el hijo.
Las mujeres embarazadas con VIH pueden tomar los mismos medicamentos que las mujeres con VIH que no están embarazadas. Solo se cambian si algún efecto secundario representa un riesgo alto para la madre o el feto.
Las mujeres que ya tomaban medicamentos antes del embarazo pueden seguir haciéndolo. Es crucial que sigan el tratamiento correctamente (horas, dosis, etc.). Es posible que, durante el embarazo, el médico decida ajustar el tratamiento para reducir los efectos secundarios.
El bebé tiene más riesgo de infectarse con VIH durante el parto al pasar por el canal de parto, ya que está expuesto a la sangre y otros fluidos de la madre. Por eso, en esta situación, se administra zidovudina por vía intravenosa a madres con carga viral alta (>1000 copias/mL) o desconocida. Este medicamento puede pasar la placenta y proteger al bebé para que no se infecte.
Además, para estas mujeres embarazadas con carga viral alta o desconocida, se recomienda una cesárea programada para reducir el riesgo de transmisión vertical del VIH. En estos casos, el parto se programa para la semana 38 del embarazo, dos semanas antes de la fecha estimada.
En cualquier caso, se debe hacer un seguimiento del tratamiento antirretroviral (TAR). La carga viral en la sangre es el principal factor para monitorear. Se recomienda medirla al inicio del TAR y a las 4 semanas, y luego cada 3-4 meses. Si las cargas virales son bajas y estables, se puede espaciar hasta 12 meses.
Se considera que el tratamiento no funciona si la carga viral es detectable después de 24 semanas de iniciar el TAR, o si después de ser indetectable, vuelve a ser >50 copias/mL en dos pruebas seguidas.
¿Cómo se detecta el VIH?
La prueba de diagnóstico del VIH se debe realizar a: mujeres embarazadas, a todas las personas que la soliciten por sospechar una posible exposición, parejas de personas con VIH, personas que usan sustancias intravenosas, personas de países con alta prevalencia (más del 1% de la población infectada), en casos de donación de sangre, trasplantes de órganos, y en estudios de donantes para técnicas de reproducción humana asistida.
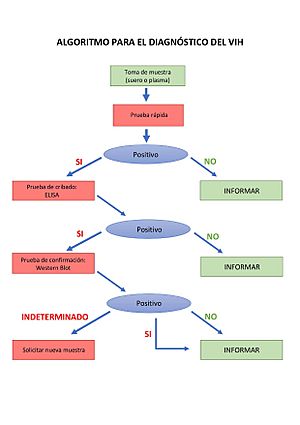
Como no hay síntomas específicos del VIH, la prueba para detectarlo debe hacerse en un laboratorio mediante pruebas de diagnóstico molecular. Desde 2002, la FDA (Administración de Alimentos y Medicamentos) aprobó el uso de pruebas rápidas. Estas pruebas las realiza personal capacitado y dan un resultado en unos 20 minutos. Funcionan como una prueba que detecta anticuerpos para los tipos de virus de la inmunodeficiencia humana 1 y 2 (VIH-1 y VIH-2), así como VIH-1 Tipo 0, en suero o plasma humano. Cada prueba tiene una banda que detecta proteínas del VIH. La prueba se puede hacer con saliva o con una pequeña muestra de sangre del dedo. El resultado indica si es "Reactivo" (posiblemente positivo) o "No reactivo" (negativo). Si el resultado es reactivo, se necesita una prueba de laboratorio para confirmar y descartar un falso positivo.
La Prueba Rápida de VIH 1&2 es una prueba de detección inicial. Como la producción de anticuerpos puede tardar después de la exposición, un resultado negativo no descarta la posibilidad de infección. Antes de estas pruebas rápidas, la prueba más común para detectar el VIH era la ELISA. Esta técnica busca los anticuerpos que el cuerpo produce contra el virus. En países donde la enfermedad es poco común, un resultado positivo con ELISA debe confirmarse con otra prueba llamada western blot antes de informar al paciente. Sin embargo, en países o grupos donde el VIH es muy común, la confirmación con western blot no es necesaria. Desde 2019, la Organización Mundial de la Salud recomienda dejar de usar las pruebas de western blot y los inmunoensayos en línea para la detección del VIH.
Por lo tanto, en la mayoría de los casos, la presencia de VIH se detecta con una muestra de sangre que se analiza para encontrar anticuerpos anti-VIH con técnicas como ELISA. Las pruebas de diagnóstico del VIH tienen una especificidad (capacidad de dar negativo si no hay enfermedad) del 99% y una sensibilidad (capacidad de dar positivo si hay enfermedad) del 99%.
Además de las pruebas de anticuerpos (ELISA), existen otros tipos de pruebas:
- Pruebas de combinación detectan anticuerpos y antígenos del VIH en la sangre. Estas pruebas pueden detectar la infección antes que una prueba de solo anticuerpos. Los antígenos y anticuerpos tardan entre 2 y 6 semanas en ser detectables. Estas pruebas son cada vez más comunes.
- Las pruebas de ácido nucleico buscan la presencia del VIH en la sangre. Pueden detectar el VIH entre 7 y 28 días después de la infección. Este tipo de prueba es muy costoso y no se usa comúnmente, a menos que la persona haya tenido una exposición de alto riesgo o presente los primeros síntomas. Entre estas pruebas está la PCR nested o anidada, que es muy precisa pero no cuantifica. Para detectar el virus insertado en el ADN de la célula, se usa una PCR anidada. Para detectar el ARN viral, se usa RT-PCR anidada.
¿Hay una vacuna contra el VIH?
En la actualidad, un grupo de investigación español del CSIC ha presentado una posible vacuna contra el VIH, la vacuna MVA-B.
La vacuna MVA-B se llama así por su composición, que usa el virus Vaccinia Modificado de Ankara (MVA). La letra B se refiere al subtipo de VIH contra el que actúa, que es el más común en Europa.
Esta vacuna está en la fase I de desarrollo y ha mostrado ser muy segura y efectiva. El 90% de los voluntarios que recibieron la vacuna MVA-B generaron una respuesta de defensa contra el VIH, y el 85% de ellos la mantuvo por al menos un año.
Para crear la vacuna MVA-B, se introdujeron cuatro genes del VIH (Gag, Pol, Nef y Env) en el código genético del virus vaccinia. Si el sistema inmune está sano, reacciona contra el MVA. Los genes del VIH insertados no pueden infectar a los humanos, lo que asegura que el estudio clínico es seguro.
A pesar de estos buenos resultados, la vacuna aún no puede venderse. Debe completar con éxito todas las fases de desarrollo del ensayo clínico para poder salir al mercado.
|
Véase también
 En inglés: HIV Facts for Kids
En inglés: HIV Facts for Kids
- Subtipos de VIH
- Sobreinfección por el VIH
- Cronología del VIH/sida
- CCR5
- Complejo de demencia asociado al VIH
- Negacionismo del VIH/sida
- Pandemia de VIH/sida
- Prueba de VIH
- Retrovirus
- Serofobia
- Sida
- VIH en el niño
- VIH en la mujer
- Campaña global Indetectable=Intransmisible