Apoptosis para niños
La apoptosis (que viene del griego antiguo apóptōsis, que significa "caída" o "desprendimiento") es un proceso natural en el que las células de nuestro cuerpo se autodestruyen de forma controlada. Es como si las células tuvieran un programa interno para desaparecer cuando ya no son necesarias o están dañadas. Este proceso es muy importante para el desarrollo y el buen funcionamiento de los seres vivos.
A diferencia de la necrosis, que es la muerte de células por un daño repentino o una lesión, la apoptosis es un proceso ordenado y beneficioso. Por ejemplo, cuando somos bebés en el vientre de nuestra madre, nuestros dedos están unidos por una especie de membranas. La apoptosis se encarga de eliminar esas células para que nuestros dedos se separen y se formen correctamente.
La apoptosis es un tema muy estudiado en la biología celular y en la investigación de enfermedades como el cáncer. De hecho, en 2002, los científicos Sydney Brenner, H. Robert Horvitz y John E. Sulston ganaron el Premio Nobel por sus descubrimientos sobre cómo los genes controlan el desarrollo de los órganos y la muerte celular programada.
Contenido
¿Qué significa la palabra Apoptosis?
La palabra apoptosis viene del griego apóptōsis. Se forma con apó, que significa "a partir de", y ptōsis, que significa "caída". Por eso, a la apoptosis también se le llama "muerte celular programada" o "muerte celular apoptótica", porque las células se "caen" o se eliminan de forma controlada.
¿Para qué sirve la Apoptosis?
La apoptosis es un proceso de "autodestrucción" celular que se activa mediante mecanismos específicos. Es como si la célula recibiera una señal para desaparecer.
¿Cómo ayuda la Apoptosis a los tejidos dañados o con infecciones?
La apoptosis puede ocurrir, por ejemplo, cuando una célula está dañada y no se puede reparar, o cuando ha sido infectada por un virus. La "decisión" de que una célula inicie la apoptosis puede venir de la propia célula, de los tejidos que la rodean o de una reacción de nuestro sistema inmunológico.
Si una célula dañada no puede realizar la apoptosis (por ejemplo, por un cambio en su ADN o si un virus lo impide), esa célula podría seguir dividiéndose sin control. Esto puede llevar a la formación de un cáncer.
¿Cómo regula la Apoptosis el sistema inmunitario?
Algunas células de nuestro sistema inmunitario, como los linfocitos B y linfocitos T, podrían llegar a atacar por error a las células sanas de nuestro propio cuerpo. Para evitar esto, estas células "autorreactivas" son eliminadas por apoptosis.
Por ejemplo, antes de que los linfocitos T salgan a defender el cuerpo, se forman en la médula ósea y luego van a un órgano llamado timo. Allí se les hacen pruebas para asegurarse de que no atacarán a las células sanas. Si una célula T muestra tendencia a atacar el propio cuerpo, es destruida por apoptosis. Por eso, alrededor del 95% de los linfocitos T recién creados son eliminados de esta manera.
¿Qué papel juega la Apoptosis en el desarrollo?
La muerte celular programada es una parte esencial del desarrollo de los tejidos, tanto en plantas como en animales. Este proceso no causa la inflamación que sí ocurre cuando las células mueren por daño (necrosis).
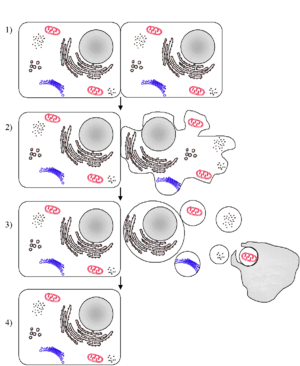
En la apoptosis, las células y sus núcleos se encogen y a menudo se fragmentan. De esta forma, otras células especializadas pueden "comerlas" (un proceso llamado fagocitosis) y reutilizar sus componentes.
Hay dos razones principales por las que las células mueren por apoptosis:
- Eliminar células que sobran:
* Cuando los renacuajos pierden su cola al convertirse en ranas. * La eliminación de las membranas entre los dedos de un feto para que se formen correctamente. * En un pequeño gusano llamado C.elegans, 131 células se eliminan por apoptosis para que llegue a su estado adulto. * La eliminación del revestimiento del útero al inicio de la menstruación. * La formación de las sinapsis (conexiones) entre las neuronas en el cerebro requiere la eliminación de algunas células.
- Eliminar células que son un peligro:
* Células infectadas por virus son destruidas por los linfocitos T. * Células del sistema inmune que ya no son necesarias después de una respuesta de defensa. Si estas células no se eliminaran, podrían causar enfermedades en las que el sistema inmune ataca al propio cuerpo, como el lupus eritematoso o la artritis reumatoide. * Células con el ADN dañado. Si el ADN de una célula está dañado, podría desarrollar cáncer. Las células responden a este daño aumentando la producción de una proteína llamada p53, que puede inducir la apoptosis. Si la p53 no funciona bien, las células dañadas pueden seguir dividiéndose y formar tumores. * Células cancerosas. Algunos tratamientos contra el cáncer, como la radioterapia y la quimioterapia, buscan inducir la apoptosis en las células cancerosas.
¿Cómo ayuda la Apoptosis a mantener el equilibrio del cuerpo (Homeostasis)?
En un organismo adulto, la cantidad de células en un órgano o tejido debe mantenerse constante. Por ejemplo, las células de la sangre y de la piel se renuevan constantemente. Esto significa que la creación de nuevas células debe ser equilibrada con la muerte de otras. Este proceso se llama homeostasis, y asegura que nuestro cuerpo funcione correctamente y mantenga su equilibrio.
¿Cómo funciona la Apoptosis?
Los procesos de apoptosis pueden activarse de varias maneras:
- Por falta de señales: Cuando una célula pierde el contacto con otras células, o le faltan factores de crecimiento que la mantienen viva.
- Por señales positivas: Cuando una molécula se une a un receptor específico en la célula, dándole la orden de morir.
La investigación científica ha identificado tres vías principales para la apoptosis: la extrínseca, la intrínseca y la de perforina/granzima.
Vía Extrínseca
Esta vía se activa por señales que vienen de fuera de la célula. Involucra a unos receptores especiales en la superficie de la célula, llamados "receptores de muerte". Cuando una molécula específica (un "ligando") se une a estos receptores, se activa una serie de proteínas llamadas caspasas (especialmente las caspasas 8 y 10). Una vez que estas caspasas se activan, la célula comienza la fase final de la apoptosis. Las caspasas "ejecutoras" (como las caspasas 3, 6 y 7) cortan y degradan proteínas importantes dentro de la célula, lo que lleva a los cambios que vemos en una célula que está muriendo por apoptosis.
Vía Intrínseca
A diferencia de la vía extrínseca, esta vía se activa por señales que vienen de dentro de la célula. Puede ser desencadenada por daño en el ADN, un aumento grande de calcio dentro de la célula o estrés celular. Esto activa una proteína llamada p53, que a su vez activa otras proteínas que afectan a las mitocondrias (las "centrales de energía" de la célula).
Cuando las mitocondrias se ven afectadas, liberan una molécula llamada citocromo C. El citocromo C se une a otras proteínas para formar un complejo llamado apoptosoma, que activa la caspasa-9. Una vez que la caspasa-9 está activa, se activan otras caspasas (como las 3 y 7), que digieren componentes esenciales de la célula, llevando a su muerte.
Fase de Decisión
Cuando una célula recibe una señal para morir, debe "decidir" si sobrevive o si activa el proceso de apoptosis. En esta fase, la mitocondria juega un papel fundamental. Uno de los eventos principales es que las membranas de las mitocondrias cambian, lo que permite la liberación de sustancias importantes como el citocromo C y otras proteínas de la familia de las caspasas.
Fase de Ejecución
Una vez que la célula ha "decidido" morir, se activan una serie de procesos bioquímicos que degradan las proteínas y el material genético (cromatina) de la célula. Entre las proteínas implicadas en este proceso están las caspasas, las calpaínas y la granzima B.
Las caspasas son como "tijeras moleculares" que cortan proteínas específicas. Entre sus "víctimas" se encuentran proteínas que forman el esqueleto de la célula, enzimas que reparan el ADN y otras proteínas reguladoras. Las calpaínas también son importantes y se activan en situaciones de estrés celular.
Véase también
 En inglés: Apoptosis Facts for Kids
En inglés: Apoptosis Facts for Kids
- Apaf-1
- Autolisis
- Neurodegeneración
- Biología celular
- Bcl-2
- Cáncer
- Caspasa
- Inmunología
- Necrobiosis
- Necrosis
- P53