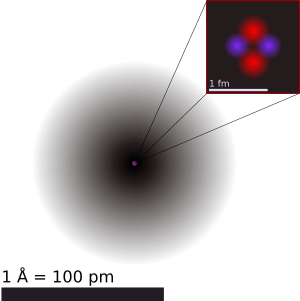
Teoría atómica para niños
La teoría atómica es una idea científica muy importante en la química y la física. Nos dice que toda la materia está formada por unidades muy pequeñas llamadas átomos. Esta idea comenzó hace mucho tiempo, en la Antigua Grecia, como un concepto filosófico. Sin embargo, no fue hasta principios del siglo XIX cuando los científicos la aceptaron de verdad. Esto ocurrió porque los descubrimientos en química mostraron que la materia se comportaba como si estuviera hecha de estas pequeñas partículas.
La palabra "átomo" viene del griego antiguo átomos, que significa "indivisible". Los químicos del siglo XIX usaron este término para referirse a los elementos químicos que no podían dividirse en algo más simple. Pero, a principios del siglo XX, los físicos descubrieron algo sorprendente. Gracias a experimentos con electromagnetismo y radiactividad, se dieron cuenta de que los "átomos indivisibles" en realidad estaban formados por partículas aún más pequeñas. Estas se llaman partículas subatómicas, como los electrones, protones y neutrones. Estas partículas pueden existir por separado. De hecho, en lugares muy extremos, como las estrellas de neutrones, la presión y la temperatura son tan altas que los átomos no pueden existir.
Como se descubrió que los átomos sí podían dividirse, los físicos crearon el término "partículas elementales". Estas son las partes más pequeñas e "indivisibles" de un átomo, aunque no son indestructibles. La física de partículas es la ciencia que estudia estas partículas subatómicas. En este campo, los científicos buscan entender la verdadera naturaleza fundamental de la materia.
Contenido
¿Cómo surgió la idea del átomo?
La idea de que la materia está hecha de unidades pequeñas es muy antigua. Apareció en muchas culturas, como en la Antigua Grecia con pensadores como Demócrito y Leucipo de Mileto. También en Roma con Lucrecio, y en la India con diferentes escuelas de pensamiento. Sin embargo, estas ideas se basaban más en la filosofía y la religión que en pruebas y experimentos. Por eso, no todos estaban convencidos. El atomismo era solo una de varias teorías sobre la materia.
No fue hasta el siglo XIX cuando los científicos adoptaron y mejoraron esta idea. La ciencia de la química estaba creciendo y producía descubrimientos que se podían explicar fácilmente usando el concepto del átomo. También fue importante la influencia del científico serbio Ruđer Bošković. Él fue el primero en proponer una teoría atómica moderna basada en las ideas de Newton, que hablaba de fuerzas de unión y de repulsión entre las partículas.
Las leyes de la química y John Dalton
A finales del siglo XVIII, surgieron dos leyes importantes sobre las reacciones químicas, incluso antes de que se hablara de la teoría atómica. La primera fue la Ley de conservación de la masa, propuesta por Antoine Lavoisier en 1789. Esta ley dice que la masa total de las sustancias no cambia durante una reacción química. Es decir, la masa de lo que reacciona es igual a la masa de lo que se produce.
La segunda fue la Ley de las proporciones constantes, demostrada por Joseph Louis Proust en 1799. Esta ley establece que, si un compuesto se descompone en sus elementos, las masas de esos elementos siempre estarán en las mismas proporciones, sin importar la cantidad o de dónde venga la sustancia original.
John Dalton estudió y amplió estos trabajos. Él desarrolló la ley de las proporciones múltiples. Esta ley dice que si dos elementos se combinan para formar varios compuestos, las proporciones de las masas del segundo elemento que se unen con una masa fija del primero siempre serán números enteros pequeños. Por ejemplo, Proust había estudiado óxidos de estaño. Dalton notó que 100 gramos de estaño se combinaban con 13.5 gramos o 27 gramos de oxígeno. La relación entre 13.5 y 27 es 1:2. Dalton se dio cuenta de que una teoría atómica podía explicar este patrón de forma sencilla. En el caso de los óxidos de estaño, un átomo de estaño se combinaba con uno o dos átomos de oxígeno.
Dalton también pensó que la teoría atómica podía explicar por qué el agua absorbe diferentes gases en distintas proporciones. Por ejemplo, el agua absorbe mucho mejor el dióxido de carbono que el nitrógeno. Dalton supuso que esto se debía a las diferencias en la masa y la complejidad de las partículas de cada gas. Las moléculas de dióxido de carbono (CO2) son más pesadas y grandes que las de nitrógeno (N2).

Dalton propuso que cada elemento químico está formado por átomos de un solo tipo. Estos átomos no pueden ser cambiados ni destruidos por medios químicos, pero sí pueden unirse para formar estructuras más complejas, que son los compuestos químicos. Esta fue la primera teoría verdaderamente científica del átomo, porque Dalton llegó a sus conclusiones a través de experimentos y analizando los resultados.
En 1803, Dalton presentó su primera lista de pesos atómicos relativos. Publicó este trabajo en 1805. Aunque sus primeros cálculos no eran perfectos debido a que no sabía que algunos elementos existen como moléculas (como el oxígeno O2) y a que creía que el compuesto más simple siempre era un átomo de cada elemento (pensó que el agua era HO, no H2O), su trabajo fue un gran avance.
La contribución de Avogadro
El error en la teoría de Dalton fue corregido en 1811 por Amedeo Avogadro. Avogadro propuso que volúmenes iguales de dos gases diferentes, a la misma presión y temperatura, contienen el mismo número de moléculas. Esto significa que la masa de las partículas de un gas no afecta el volumen que ocupa.
La ley de Avogadro le permitió entender que muchos gases existen como moléculas de dos átomos (diatómicas). Por ejemplo, si dos litros de hidrógeno reaccionan con un litro de oxígeno para producir dos litros de vapor de agua (a la misma temperatura y presión), significa que una molécula de oxígeno se divide en dos para formar dos moléculas de agua. Así, Avogadro pudo calcular con más precisión la masa atómica del oxígeno y de otros elementos, y también hizo una distinción clara entre moléculas y átomos.
El movimiento browniano y la prueba de la existencia de átomos
En 1827, el botánico británico Robert Brown observó algo curioso. Vio que las partículas de polvo dentro de los granos de polen que flotaban en el agua se movían constantemente sin razón aparente. En 1905, Albert Einstein explicó que este movimiento browniano era causado por el choque continuo de las moléculas de agua contra las partículas de polen. Desarrolló un modelo matemático para describirlo. En 1908, el físico francés Jean Perrin lo demostró experimentalmente. Esto dio una prueba más de que la materia está hecha de partículas, apoyando la teoría atómica.
¿Cómo descubrimos las partes del átomo?
Hasta 1897, se pensaba que los átomos eran la parte más pequeña de la materia. Pero ese año, J. J. Thomson descubrió el electrón usando un tubo de rayos catódicos. Este tubo era un recipiente de vidrio cerrado con dos electrodos separados por vacío. Cuando se aplicaba electricidad, se generaban rayos catódicos que brillaban al chocar con el otro extremo del tubo.
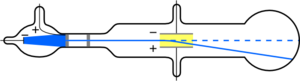
Thomson descubrió que estos rayos se desviaban al aplicar un campo eléctrico (además de desviarse con campos magnéticos, algo que ya se sabía). Él afirmó que estos rayos no eran ondas, sino que estaban compuestos por partículas con carga negativa. Las llamó "corpúsculos", que más tarde otros científicos renombraron como "electrones".
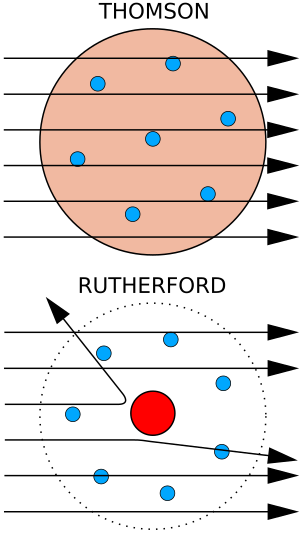
Thomson creyó que estos corpúsculos venían de los átomos del electrodo. Así, propuso que los átomos eran divisibles y que los corpúsculos eran sus componentes. Para explicar que el átomo es neutro (no tiene carga eléctrica), sugirió que los corpúsculos estaban distribuidos en anillos dentro de una "nube" positiva uniforme. Este fue el modelo atómico de Thomson, también conocido como el "modelo del pudín de pasas".
Como se vio que los átomos sí eran divisibles, los físicos inventaron el término "partículas elementales" para referirse a las partículas que no se podían dividir.
El descubrimiento del núcleo atómico
El modelo de Thomson fue refutado en 1909 por uno de sus estudiantes, Ernest Rutherford. Rutherford descubrió que la mayor parte de la masa y de la carga positiva de un átomo estaba concentrada en una parte muy, muy pequeña de su volumen, justo en el centro.
En su experimento, Hans Geiger y Ernest Marsden lanzaron partículas alfa (que son partículas con carga positiva) a través de una lámina muy delgada de oro. Alrededor de la lámina, habían colocado una pantalla que brillaba cuando las partículas chocaban. Según el modelo de Thomson, esperaban que todas las partículas alfa pasaran sin desviarse o que fueran absorbidas, porque los electrones son muy ligeros y la carga positiva estaba distribuida uniformemente. Para su sorpresa, una pequeña parte de las partículas alfa se desvió mucho. Esto llevó a Rutherford a proponer el modelo planetario del átomo. En este modelo, los electrones giran alrededor de un núcleo grande y compacto, como los planetas alrededor del Sol.
El descubrimiento de los isótopos
En 1913, Thomson hizo pasar una corriente de iones de neón a través de campos magnéticos y eléctricos. Estos iones chocaron con una placa fotográfica. Thomson vio dos zonas brillantes en la placa, lo que indicaba dos trayectorias de desviación diferentes. Concluyó que esto se debía a que algunos iones de neón tenían masas distintas. Así fue como descubrió la existencia de los isótopos, que son átomos del mismo elemento con diferente número de neutrones.
El descubrimiento del neutrón
En 1918, Rutherford logró "partir" el núcleo del átomo al bombardear gas nitrógeno con partículas alfa. Observó que el gas emitía núcleos de hidrógeno. Rutherford concluyó que estos núcleos de hidrógeno venían de los núcleos de los propios átomos de nitrógeno. Más tarde, descubrió que la carga positiva de cualquier átomo siempre era un número entero de núcleos de hidrógeno. Esto, junto con el hecho de que el hidrógeno (el elemento más ligero) tenía una masa atómica de 1, lo llevó a afirmar que los núcleos de hidrógeno eran partículas únicas, los componentes básicos de todos los núcleos atómicos: había descubierto el protón.
Un experimento posterior de Rutherford mostró que la masa del núcleo de la mayoría de los átomos era mayor que la de los protones que contenía. Por lo tanto, propuso que existían partículas sin carga, hasta entonces desconocidas, que más tarde se llamarían neutrones, y que explicaban este exceso de masa.
En 1928, Walther Bothe observó que el berilio emitía una radiación eléctricamente neutra cuando se le bombardeaba con partículas alfa. En 1932, James Chadwick expuso varios elementos a esta radiación y dedujo que estaba compuesta por partículas eléctricamente neutras con una masa similar a la de un protón. Chadwick llamó a estas partículas "neutrones".
Los modelos cuánticos del átomo
El modelo planetario del átomo de Rutherford tenía algunos problemas. Por ejemplo, según las leyes del electromagnetismo clásico, una carga eléctrica que se mueve en círculos (como un electrón orbitando) debería emitir ondas electromagnéticas y perder energía. Esto haría que el electrón cayera en espiral hacia el núcleo. Otro problema era que el modelo no explicaba por qué los átomos excitados solo emiten luz con ciertos colores específicos (llamados espectros discretos).
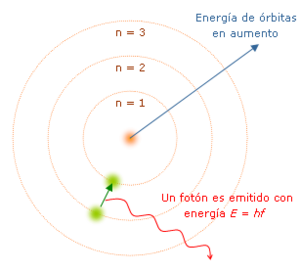
La teoría cuántica revolucionó la física a principios del siglo XX. Max Planck y Albert Einstein propusieron que la energía se emite o absorbe en cantidades fijas llamadas cuantos. En 1913, Niels Bohr usó esta idea en su modelo atómico. En este modelo, los electrones solo podían girar alrededor del núcleo en órbitas circulares específicas, con una energía y un momento angular fijos. Las distancias al núcleo correspondían a niveles de energía. Según este modelo, los átomos no caerían en espiral hacia el núcleo porque no podían perder energía de forma continua. En cambio, solo podían hacer "saltos cuánticos" instantáneos entre estos niveles fijos de energía. Cuando esto ocurre, el átomo absorbe o emite luz a una frecuencia que depende de la diferencia de energía, lo que explica los espectros discretos. Arnold Sommerfeld amplió el modelo de Bohr en 1916 para incluir órbitas elípticas.
El modelo de Bohr-Sommerfeld era complicado de usar, pero hacía predicciones asombrosas para algunas propiedades de los espectros. Sin embargo, no podía explicar átomos con muchos electrones ni predecir la velocidad de las transiciones.
En 1924, Louis de Broglie propuso que todos los objetos, especialmente las partículas subatómicas como los electrones, podían tener propiedades de ondas. Erwin Schrödinger, fascinado por esta idea, investigó si el movimiento de un electrón en un átomo se podía explicar mejor como una onda que como una partícula. La ecuación de Schrödinger, publicada en 1926, describe al electrón como una función de onda en lugar de una partícula. Esta ecuación predijo muchos fenómenos que el modelo de Bohr no podía explicar. Aunque era matemáticamente correcta, era difícil de imaginar. Uno de sus críticos, Max Born, dijo que la función de onda de Schrödinger no describía al electrón en sí, sino las probabilidades de encontrarlo en diferentes lugares alrededor del núcleo.
En 1927, Werner Heisenberg señaló que, como una función de onda depende del tiempo y la posición, es imposible conocer con total precisión la posición y el momento de una partícula al mismo tiempo. Este principio se conoce como el principio de incertidumbre de Heisenberg.
Este nuevo enfoque cambió por completo el modelo de Bohr, con sus órbitas circulares bien definidas. El modelo moderno del átomo describe las posiciones de los electrones en términos de probabilidades. Un electrón puede estar potencialmente a cualquier distancia del núcleo, pero, dependiendo de su nivel de energía, tiende a estar más a menudo en ciertas regiones alrededor del núcleo que en otras. Estas zonas se conocen como orbitales atómicos.
¿Por qué es importante la teoría atómica?
La importancia de esta teoría es enorme. Se ha dicho, por ejemplo, por el premio Nobel Richard Feynman, que la teoría atómica es la teoría más importante en la historia de la ciencia. Esto se debe a las grandes consecuencias que ha tenido, tanto para la ciencia básica como para las aplicaciones que se han desarrollado a partir de ella.
Toda la química y la bioquímica modernas se basan en la idea de que la materia está compuesta por átomos de diferentes elementos. Estos átomos no pueden cambiarse de un elemento a otro por métodos químicos. La química, a su vez, ha permitido el desarrollo de muchas industrias, como la industria farmacéutica, la petroquímica, la de abonos, y la creación de nuevos materiales, incluyendo los semiconductores, y muchos otros avances.
Para saber más
- Atomismo
- Termodinámica
- Mecánica cuántica
- Química cuántica
- Física molecular
- Historia de la teoría atómica
- Cronología de la física atómica y subatómica