Historia de la teoría atómica para niños
La idea de que toda la materia está hecha de partículas muy pequeñas llamadas átomos es muy antigua. Surgió hace mucho tiempo, alrededor del siglo VI antes de Cristo.
En la Antigua India, pensadores como los vaisesika y los nyaya crearon teorías detalladas sobre cómo los átomos se unían para formar objetos complejos.
Los griegos también buscaron entender la materia. A diferencia de otros, ellos querían explicar por qué las cosas cambian y, al mismo tiempo, permanecen. La teoría atómica fue olvidada por mucho tiempo y no se volvió a investigar hasta el Renacimiento y los siglos siguientes. Fue entonces cuando se sentaron las bases del modelo atómico que hoy consideramos correcto, presentado por John Dalton.
Antes del modelo atómico actual, hubo muchas ideas para explicar la materia. Por ejemplo, el modelo cinético de Daniel Bernoulli y, en el siglo XX, el modelo cinético de partículas o molecular. Estos modelos intentaban explicar, sobre todo, cómo se comportan los gases.
También surgieron teorías importantes que ayudaron a entender estos modelos, como la ley de Avogadro y el movimiento browniano.
Al principio, el modelo de partículas no podía explicar algunos fenómenos. Esto hizo que los científicos cambiaran la idea de que la materia solo estaba hecha de partículas con masa. Hoy, el modelo más aceptado es el atómico. Este modelo dice que los componentes básicos de la materia tienen otras propiedades que nos ayudan a entender muchos fenómenos.
La creación del modelo atómico abrió nuevas áreas de estudio, como la fuerza nuclear. También llevó a grandes avances que aumentaron nuestro conocimiento, como la tabla periódica de los elementos creada por Dimitri Ivanovich Mendeleev. Antes de él, hubo otras tablas, pero no fueron tan aceptadas.
Hoy en día, el objetivo de la teoría atómica es ayudarnos a entender la composición, propiedades, estructura y cambios del universo. Para lograr esto, se empezó por lo más simple: los átomos, que conocemos gracias a las teorías que se han desarrollado a lo largo de la historia. Estas teorías son muy importantes para la química y han dejado un gran legado.
Contenido
¿Cómo surgieron las primeras ideas sobre los átomos?
Los primeros modelos de la materia
El pensamiento en la India antigua
Los primeros modelos que intentaron explicar de qué estaba hecha la materia surgieron en los últimos siglos antes de Cristo en la Antigua India. Aparecieron en las filosofías vaisesika y niaiá, y también en la religión yainista.
El primer filósofo que organizó ideas sobre el átomo de forma sistemática fue Kanada. Pakudha Katyayana, que también vivió en el siglo VI antes de Cristo, fue otro filósofo que propuso ideas sobre cómo estaba hecho el mundo material a partir de átomos.
Los pensadores indios creían que un átomo podía ser uno de hasta seis o siete elementos, y que cada uno tenía hasta 24 propiedades. Desarrollaron teorías detalladas sobre cómo los átomos podían combinarse, reaccionar, vibrar, moverse y hacer otras cosas importantes. Tenían ideas muy elaboradas sobre cómo se unían los átomos. Decían que primero se unían en parejas, y luego se agrupaban en tríos de pares, que son las unidades visibles más pequeñas de la materia (como el electrón, el neutrón y el protón).
También imaginaron la posibilidad de dividir un átomo. Con el tiempo, algunas personas no aceptaron sus ideas, pero para otras, fueron una inspiración para seguir investigando.
El pensamiento en la Grecia antigua
En la Antigua Grecia, uno de los primeros filósofos en intentar explicar la materia fue Tales de Mileto. Él propuso que el agua era el elemento básico que formaba todas las cosas del universo. Pensaba esto porque el agua es muy abundante: rodea la Tierra, está en el aire como vapor, corre por los continentes, y la vida no sería posible sin ella. Anaxímenes (585-524 a.C.), otro filósofo griego de Mileto, sugirió que el aire era esa sustancia fundamental.
Heráclito, de la ciudad de Éfeso, creía que lo que caracterizaba todo en el Universo era el cambio constante. Por eso, pensó que el fuego era la "sustancia" que mejor describía esto.
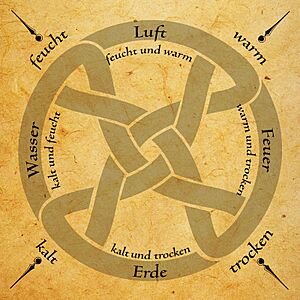
Empédocles (490-439 a.C.), nacido en Sicilia, pensó que la respuesta no era un solo "elemento", sino todos los que ya se habían propuesto: agua, aire, fuego, y añadió un cuarto: la tierra. Aseguraba que cada "elemento" tenía un lugar en el orden del Universo: el fuego arriba, luego el aire, el agua y, por último, la tierra.
La búsqueda para definir lo que no se podía ver de la materia continuó con Aristóteles. Sus ideas fueron muy influyentes en Europa por más de 2000 años. Él pensaba que los "elementos" de Empédocles eran combinaciones de dos pares de propiedades opuestas: frío y calor; humedad y sequedad. Estas propiedades podían combinarse, excepto con sus opuestos, formando cuatro parejas distintas, cada una dando origen a un "elemento": calor y sequedad formaban el fuego; calor y humedad, el aire; frío y sequedad, la tierra; y frío y humedad, el agua.
Aristóteles también creía que los cielos estaban hechos de un "quinto elemento" llamado éter. Consideraba que el éter era perfecto, eterno e inmutable, diferente de los cuatro elementos "imperfectos" de la Tierra. Sin embargo, Aristóteles no pensaba que cada "elemento" fuera igual a las sustancias reales que les daban nombre. Por ejemplo, el agua como elemento no era el agua que se podía tocar en un río. Él creía que la experiencia a través de los sentidos era la mejor forma de conocer el mundo. Por eso, usó dos pares de cualidades sensibles (caliente-frío y húmedo-seco) para explicar el origen de los elementos primarios. Esta forma de pensar explicaba fácilmente cómo una sustancia podía cambiar a otra, por lo que fue muy aceptada por los alquimistas. Es importante entender que cuando Aristóteles decía "agua", se refería a cualquier material que se sintiera frío y húmedo. La idea de "elemento" que tenían los antiguos griegos no es la misma que se usa hoy en química. En la Antigüedad, se pensaba que los elementos eran "principios" que, al cambiar, originaban todas las cosas. Hoy sabemos que el agua está formada por átomos de hidrógeno y oxígeno; la tierra es una mezcla de muchas sustancias; el aire es una mezcla de diferentes gases; y el fuego es una forma de energía que se produce en una reacción química (con luz y calor).
El modelo cinético molecular: ¿Cómo se mueven las partículas?
La información que podemos obtener de la materia se limita a observar y medir algunas de sus propiedades, como su volumen, masa, temperatura y color. Para explicar estas propiedades, se propuso el modelo cinético molecular o modelo cinético corpuscular. Este modelo requirió mucha imaginación, ya que decía que las partículas que forman la materia son tan pequeñas que no se pueden ver a simple vista. Este modelo cambió con el tiempo y buscaba explicar tanto las propiedades grandes (macroscópicas) como las muy pequeñas (microscópicas) de la materia.
El modelo cinético de la materia surgió a principios del siglo XVIII. El matemático suizo Daniel Bernoulli usó la idea de una esfera rígida para representar las partículas que forman la materia.
Sin embargo, esta idea, y la existencia de los átomos y las moléculas, no fue aceptada por mucho tiempo. Años después, en 1811, el italiano Amadeo Avogadro propuso lo que hoy se conoce como la Ley de Avogadro. Él asumió que los gases estaban hechos de partículas y dijo:
Si tomamos dos o más gases, cualesquiera que estos sean, los combinamos en recipientes de igual volumen, y los mantenemos en iguales condiciones, el número de partículas de todos estos gases es el mismo.Avogadro
Entre 1860 y 1870, el escocés James C. Maxwell y el austriaco Ludwig Boltzmann desarrollaron la idea de que un gas está formado por muchísimos átomos o moléculas. Estas se pueden ver como pequeñas esferas duras que se mueven sin parar, chocando entre sí y contra las paredes del recipiente que las contiene. La importancia de estas ideas fue que el comportamiento de un gas podía explicarse usando las leyes de Newton aplicadas a las moléculas.
En 1872, Boltzmann sentó las bases de lo que hoy se conoce como teoría cinética moderna. Sus aportes fueron tan importantes que los resultados de su teoría siguen siendo válidos, aunque pasaron muchos años antes de que fueran ampliamente conocidos. Él dedicó los últimos años de su vida a intentar convencer a quienes se oponían a las teorías microscópicas de la materia.
Albert Einstein estudió las observaciones de un botánico inglés llamado Robert Brown. En 1827, Brown había descubierto el movimiento browniano al ver que un grano de polen suspendido en un líquido se movía continuamente al azar. Pasaron muchos años sin una explicación clara, hasta que Albert Einstein hizo un estudio y análisis matemático complejo. Propuso que el movimiento browniano ocurre por el choque de las moléculas del líquido contra las partículas suspendidas en él. De esto, dedujo ecuaciones que establecían:
- El movimiento de las partículas en movimiento browniano debe aumentar si sube la temperatura.
- El movimiento de las partículas en movimiento browniano debe ser mayor si la partícula es más pequeña.
- El movimiento de las partículas en movimiento browniano debe ser menor cuando el líquido es más espeso (tiene mayor viscosidad).
Albert Einstein
El modelo atómico de la materia: ¿Cómo lo entendemos hoy?
La historia del modelo atómico se puede dividir en tres etapas para entender cómo se pensó que estaba compuesta la materia:
- La etapa primitiva: Surgieron las primeras ideas para explicar de forma creíble cómo estaba hecha la materia por dentro.
- La etapa clásica: Se retomaron las ideas antiguas durante el Renacimiento. científicos y expertos comenzaron a debatir e investigar para crear un modelo que fuera creíble y verdadero.
- La etapa moderna: Las ideas finalmente se unieron y dieron lugar al modelo que aceptamos hasta hoy.
La etapa primitiva: Las primeras ideas

Las primeras ideas del modelo atómico vinieron del filósofo griego Leucipo y de su alumno Demócrito. Ellos definieron una unidad fundamental de la composición de la materia.
Su razonamiento fue el siguiente:
Si tengo un trozo de materia —el que sea— y comienzo a partirlo en pedazos cada vez más pequeños y vuelvo a partir los pedazos que me queden una y otra vez, llegará el momento en que tenga partículas que ya no se podrán partir más.
A estas partículas las llamaron átomos (Griego: ἄτομος), que significa "indivisible". Así, todo está formado por átomos. Las cosas son diferentes por los átomos que las forman y por cómo están organizados. Es importante saber que el objetivo de los filósofos griegos antiguos no era explicar la estructura interna de la materia, sino el cambio y la permanencia. Les intrigaba que las cosas cambiaran constantemente, pero el cosmos siempre pareciera el mismo, o que un objeto o ser cambiara pero siguiera siendo el mismo: "como el ser humano que ha cambiado desde que nace, pero que sigue siendo el mismo". Así, los atomistas griegos propusieron que en el Universo algo siempre permanecía: los átomos, y que los cambios se referían a las combinaciones de estos.
La teoría atómica fue olvidada por siglos porque incluía la idea de que entre los átomos solo hay vacío, es decir, nada. Según los atomistas, las cosas están hechas de átomos y vacío.
La etapa clásica: El renacer de la idea del átomo

Para algunos filósofos, como Aristóteles y Platón, pensar en la existencia del vacío iba en contra de su lógica. Con el surgimiento del método científico propuesto por Galileo y las leyes de Newton, en los siglos XVII y XVIII, se retomó la idea del átomo como la partícula fundamental que forma la materia. Así nació la etapa clásica de la historia de la composición de la materia, donde se estableció el modelo de partículas.
Para llegar al concepto que conocemos hoy, el modelo de la estructura de la materia evolucionó. En su obra El químico escéptico (1660), Robert Boyle fue el primero en establecer el criterio moderno para definir un elemento: una sustancia que puede combinarse con otros elementos para formar compuestos y que no puede dividirse en una sustancia más simple. Sin embargo, Boyle aún tenía algunas ideas antiguas sobre los elementos. Por ejemplo, creía que el oro no era un elemento y que podía formarse de alguna manera a partir de otros metales. Las mismas ideas compartía su contemporáneo Isaac Newton, quien dedicó gran parte de su vida a la alquimia. Newton tuvo en mente el concepto de átomo en sus trabajos de Física, especialmente en óptica.
A finales del siglo XVIII, surgieron dos leyes sobre las reacciones químicas sin mencionar la teoría atómica. La primera fue la ley de conservación de la materia, formulada por Antoine Lavoisier en 1789. Esta ley dice que en toda reacción química, la masa se mantiene igual: la masa de los materiales que reaccionan es igual a la masa de los productos obtenidos. La segunda fue la ley de las proporciones constantes, una observación fundamental de la química moderna hecha por Louis Proust. Esta ley dice que cuando dos o más elementos se combinan para formar un compuesto específico, siempre lo hacen en una relación de masas constante.
El científico inglés John Dalton, basándose en sus trabajos y experimentos, desarrolló una teoría atómica. Él propuso que cada elemento químico estaba compuesto por un solo tipo de átomo. Aunque los átomos no pueden ser cambiados ni destruidos por medios químicos, sí pueden combinarse para formar estructuras más complejas (compuestos químicos). Esto marcó la primera teoría científica verdadera del átomo, ya que Dalton llegó a sus conclusiones mediante la experimentación y el análisis de sus resultados de forma empírica. No se sabe con certeza cuánto se inspiró su teoría atómica en ideas anteriores. Dalton creía que la teoría atómica podía explicar por qué el agua absorbía diferentes gases en distintas proporciones, suponiendo que esto se debía a las diferencias en la masa y la complejidad de las partículas de los gases.
Dalton fue el primero en preguntarse por el valor de la masa de los átomos y la midió de forma indirecta. No tenía una balanza que midiera la masa de los átomos directamente, así que usó métodos indirectos, que consistían en combinar elementos para formar compuestos. Dalton se dio cuenta de que los elementos siempre se combinan en las mismas proporciones para formar un mismo compuesto. Concluyó que las cantidades de dichos elementos pueden reducirse a números enteros sencillos. Comparando diferentes elementos y las proporciones que guardan en varios compuestos, Dalton descubrió que los átomos de hidrógeno tienen la masa más pequeña. Así, tomando como unidad la masa del átomo de hidrógeno, asignó la masa atómica de otros elementos conocidos en esa época.
Galería de imágenes
-
Tabla de elementos químicos de John Dalton en su trabajo A new system of chemical philosophy (1808). Este fue uno de los primeros trabajos que explicaron y a través de fuentes, se fundamenta para dar origen a un modelo correcto que es usado en la actualidad. Esas investigaciones sirvieron para el posterior trabajo de Dimitri Ivanovich Mendeleev.
Véase también
- Cronología de la física atómica y subatómica