Modelo atómico de Bohr para niños
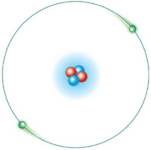
El modelo atómico de Bohr es una forma clásica de entender el átomo. Este modelo explica que los electrones giran alrededor del núcleo en caminos circulares, como si fueran planetas alrededor del Sol. Además, dice que los electrones solo pueden estar en ciertos niveles de energía específicos.
Este modelo fue propuesto en 1913 por el científico danés Niels Bohr. Su objetivo era explicar por qué los electrones pueden tener órbitas estables sin caer al núcleo. También quería entender por qué los átomos emiten luz con colores muy específicos, algo que el modelo anterior de Rutherford no podía explicar. Bohr también usó ideas del efecto fotoeléctrico, que había sido explicado por Albert Einstein.
En 1926, Erwin Schrödinger, un físico de Austria, mejoró el modelo de Bohr. Su modelo se conoce como el modelo mecánico cuántico. A diferencia del modelo de Bohr, el de Schrödinger no dice la ruta exacta de un electrón. En cambio, predice dónde es más probable encontrar un electrón. Imagina una nube alrededor del núcleo: donde la nube es más densa, es más probable que esté el electrón.
Hasta 1932, se pensaba que el átomo solo tenía un núcleo positivo y electrones negativos. Pero en 1932, James Chadwick hizo un descubrimiento importante. Encontró una partícula en el núcleo del átomo que no tiene carga eléctrica, a la que llamó neutrón.
Contenido
¿Por qué se creó el modelo de Bohr?
Bohr quería crear un modelo del átomo que pudiera explicar dos cosas importantes:
- La estabilidad de la materia.
- Los colores específicos de luz que emiten y absorben los gases (llamados espectros de emisión y absorción).
Para esto, Bohr se basó en el modelo atómico de Rutherford y en las nuevas ideas sobre la cuantización de la energía, que habían surgido de las investigaciones de Max Planck y Albert Einstein.
¿Cómo se mueven los electrones en el modelo de Bohr?
En el modelo de Bohr, los electrones giran en órbitas circulares alrededor del núcleo. Siempre buscan la órbita con la energía más baja, que es la más cercana al núcleo.
Según las leyes de la física clásica, una partícula con carga que se mueve en círculo debería perder energía y caer hacia el núcleo. Para resolver este problema, Bohr propuso algo nuevo: los electrones solo pueden moverse en órbitas especiales. Cada una de estas órbitas tiene un nivel de energía específico.
Cada órbita se identifica con un número entero llamado n, que empieza en 1. Este número n se conoce como número cuántico principal.
Bohr también supuso que el momento angular de cada electrón (que es una medida de su movimiento de giro) solo podía tener valores que fueran múltiplos de una cantidad muy pequeña llamada la constante de Planck. Con esto, calculó las distancias de las órbitas permitidas para el átomo de hidrógeno. Al principio, estas órbitas se nombraban con letras (K, L, M, etc.), pero luego se usaron números.
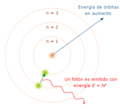
Los electrones pueden cambiar de órbita si ganan o pierden energía. Si un electrón absorbe energía, salta a una órbita más lejana. Si pierde energía, salta a una órbita más cercana. Cuando un electrón vuelve a su órbita original, libera la energía extra en forma de luz.
Las ideas principales de Bohr
En 1913, Niels Bohr presentó su modelo atómico con tres ideas fundamentales:
Primera idea: Órbitas estables
Los electrones se mueven en órbitas circulares alrededor del núcleo sin perder energía.
Esto era una idea nueva, porque la física de la época decía que una carga en movimiento circular debería emitir energía. Para que el electrón se mantenga en su órbita circular, la fuerza de atracción del núcleo (llamada fuerza coulombiana) debe ser igual a la fuerza centrípeta que lo mantiene en el círculo.
Segunda idea: Órbitas permitidas
Las únicas órbitas que un electrón puede ocupar son aquellas donde su momento angular es un múltiplo exacto de una cantidad fija (la constante de Planck dividida por 2π).
Esto significa que no todas las órbitas son posibles, solo algunas muy específicas. Gracias a esta condición, se pueden calcular los radios de las órbitas permitidas. La órbita más cercana al núcleo (cuando n=1) se llama radio de Bohr.
También se puede calcular la energía que tiene un electrón en cada una de estas órbitas permitidas. Para el átomo de hidrógeno, la energía del nivel más bajo (n=1) es de -13.6 electronvoltios (eV).
Tercera idea: Saltos de energía
El electrón solo emite o absorbe energía cuando salta de una órbita permitida a otra. Cuando esto sucede, emite o absorbe un fotón (una partícula de luz) cuya energía es exactamente la diferencia entre los niveles de energía de las dos órbitas.
La energía de este fotón se relaciona con su frecuencia (el número de ondas por segundo) mediante la ley de Planck. Esta idea fue muy importante porque pudo explicar por qué los átomos de hidrógeno emiten luz en colores específicos, algo que ya se había observado pero no se entendía bien. La fórmula de Bohr coincidía con las observaciones de Balmer sobre las líneas espectrales del hidrógeno.
Mejoras al modelo de Bohr
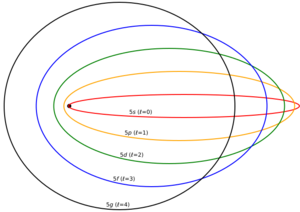
El modelo de Bohr fue un gran avance, pero no era perfecto. Se propusieron algunas mejoras, como el modelo de Sommerfeld o Bohr-Sommerfeld. Este modelo sugería que los electrones no solo se movían en órbitas circulares, sino también en órbitas elípticas alrededor del núcleo.
Sin embargo, el modelo de Bohr-Sommerfeld tenía algunas inconsistencias. Por ejemplo, no explicaba por qué un átomo podía girar libremente en el espacio. Al final, fue reemplazado por la mecánica cuántica moderna. En 1925, Wolfgang Pauli describió el átomo de hidrógeno usando la mecánica de matrices. Luego, en 1926, Erwin Schrödinger desarrolló la mecánica ondulatoria, que dio una imagen más precisa de los orbitales atómicos (las regiones donde es más probable encontrar un electrón).
A pesar de sus limitaciones, el modelo de Bohr-Sommerfeld fue útil. Pudo explicar algunos efectos más complejos en los espectros atómicos. Por ejemplo, en el efecto Stark (cuando las líneas espectrales se dividen por un campo eléctrico), el modelo de Bohr y la mecánica cuántica hacían predicciones similares en ciertos casos.
Bohr también actualizó su modelo en 1922, sugiriendo que ciertos números de electrones (como 2, 8 y 18) formaban "capas cerradas" estables alrededor del núcleo.
Otros modelos atómicos
- Modelo atómico de Thomson
- Modelo atómico de Rutherford
- Modelo atómico de Sommerfeld
- Modelo atómico de Schrödinger
- Modelo atómico de Bohr-Sommerfeld-Catalán
- Modelo del átomo cúbico
- Modelo atómico de Dalton
Galería de imágenes
Véase también
 En inglés: Bohr model Facts for Kids
En inglés: Bohr model Facts for Kids