Nitrato de sodio para niños
Datos para niños
Nitrato de sodio |
||
|---|---|---|
 |
||
 |
||
 |
||
| Nombre IUPAC | ||
| Trioxonitrato (V) de sodio | ||
| General | ||
| Otros nombres | Nitrato de sodio Nitrato sódico |
|
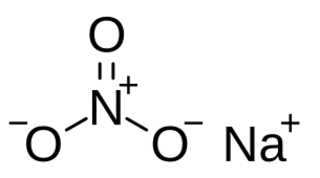
| Fórmula estructural | 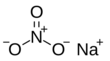 |
|
| Fórmula molecular | NaNO3 | |
| Identificadores | ||
| Número CAS | 7631-99-4 | |
| Número RTECS | WC5600000 | |
| ChEBI | 63005 | |
| ChEMBL | CHEMBL1644698 | |
| ChemSpider | 22688 | |
| DrugBank | DB15952 | |
| PubChem | 517680 24268, 517680 | |
| UNII | 8M4L3H2ZVZ | |
|
InChI
InChI=InChI=1S/NO3.Na/c2-1(3)4;/q-1;+1
Key: VWDWKYIASSYTQR-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Polvo blanco o cristales incoloros | |
| Densidad | 2260 kg/m³; 2,26 g/cm³ | |
| Masa molar | 85 g/mol | |
| Punto de fusión | 581 K (308 °C) | |
| Punto de ebullición | 653,15 K (380 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 92,1 g/100 ml (25 °C) | |
| Peligrosidad | ||
| NFPA 704 |
0
1
0
OX
|
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El nitrato de sodio o nitrato sódico es un compuesto químico con la fórmula NaNO3. Es una sustancia que se encuentra en la naturaleza y también se puede fabricar. Es uno de los componentes del salitre, una mezcla de sales.
El nitrato de sodio es un sólido de color blanco que se disuelve muy bien en agua. Es una fuente importante de un grupo de átomos llamado anión nitrato (NO3−). Este anión es muy útil en la industria para fabricar fertilizantes, materiales para fuegos artificiales, vidrio y cerámica. También se usa para conservar alimentos, especialmente carnes.
Antiguamente, se obtenía principalmente de grandes depósitos naturales. Hoy en día, se fabrica en fábricas a partir de ácido nítrico, que a su vez se produce del amoniaco.
Contenido
Historia del Nitrato de Sodio
El nitrato de sodio natural, conocido como salitre, fue muy importante en el pasado. Los primeros cargamentos de salitre llegaron a Europa desde Perú en la década de 1820. Al principio, no se vendía mucho, pero con el tiempo se convirtió en un negocio muy rentable.
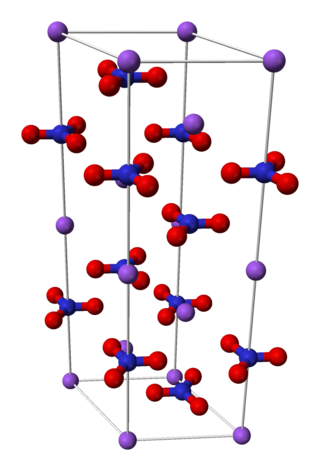
Chile tuvo un papel clave en la historia del salitre. Después de la Guerra del Pacífico (1879-1884) contra Perú y Bolivia, Chile obtuvo los yacimientos más grandes de salitre. En 1919, un científico llamado Ralph Walter Graystone Wyckoff estudió su estructura usando cristalografía de rayos X.
¿Cómo se obtiene el Nitrato de Sodio?
Durante muchos años, entre 1830 y 1920, la mayor parte del nitrato de sodio venía de los grandes depósitos naturales en los desiertos de Chile, Perú y Bolivia. De este salitre se obtenían otras sustancias importantes como el ácido nítrico y el nitrato de potasio.
Después de la Primera Guerra Mundial, se desarrolló un método llamado proceso Haber-Bosch. Este proceso permitió fabricar amoniaco de forma económica. A partir de este amoniaco, se podía producir ácido nítrico y, de ahí, nitrato de sodio y nitrato de potasio. Esto hizo que la extracción del salitre natural fuera menos necesaria y rentable.
En los laboratorios, el nitrato de sodio se puede obtener mezclando ácido nítrico con bases como el hidróxido de sodio o el carbonato de sodio.
Yacimientos Naturales de Nitrato de Sodio
Las mayores cantidades de nitrato de sodio natural se encuentran en Chile y Perú. Allí, estas sales se hallan en depósitos minerales llamados caliche. Estos nitratos se forman en la tierra por la combinación de la niebla marina, la oxidación del rocío y la acumulación de sales en el clima seco del desierto.
Durante más de cien años, casi todo el nitrato de sodio del mundo se extraía del desierto de Atacama en el norte de Chile. Sin embargo, a principios del siglo XX, los científicos alemanes Fritz Haber y Carl Bosch crearon el proceso de Haber para producir amoníaco a gran escala. Con este proceso, se pudo fabricar nitrato de sodio de forma artificial. Esto hizo que la demanda de nitrato de sodio natural disminuyera mucho a partir de la década de 1940.
Chile todavía tiene las mayores reservas de caliche. Las antiguas comunidades mineras de salitre en Chile, como Humberstone y Santa Laura, fueron declaradas Patrimonio de la Humanidad por la UNESCO en 2005.
Propiedades del Nitrato de Sodio
El nitrato de sodio es una sustancia incolora (sin color) y sin olor. Es un agente oxidante fuerte, lo que significa que puede reaccionar con otras sustancias. Si se mezcla con materiales orgánicos, puede causar reacciones muy energéticas.
Propiedades Físicas
A temperatura ambiente, el nitrato de sodio es un sólido cristalino de color blanco. Sus cristales tienen una forma especial llamada trigonal o romboédrica. Se derrite a 308 °C y se descompone (se rompe en otras sustancias) a 380 °C. Su densidad es de 2,26 gramos por centímetro cúbico.
Es muy soluble en agua: 73 gramos se disuelven en 100 gramos de agua a 0 °C, y 91,2 gramos a 25 °C. Su capacidad para disolverse aumenta con la temperatura. También se disuelve en alcohol. Las soluciones de nitrato de sodio en agua son neutras, con un pH de 7. En el aire húmedo, absorbe mucha agua.
Propiedades Químicas
El nitrato de sodio es un agente oxidante potente. Reacciona con fuerza con materiales que pueden quemarse, sustancias orgánicas y otros agentes reductores como el aluminio o el magnesio. Estas reacciones pueden generar mucho calor y energía.
Reacciones con Ácidos
Cuando el nitrato de sodio se mezcla con ácido sulfúrico, se usa para producir ácido nítrico en la industria. La reacción es: <chem display="block">NaNO3 + H2SO4 -> NaHSO4 + HNO3</chem>
Reacciones de Oxidación
Las propiedades oxidantes del nitrato de sodio se usan para crear materiales que liberan mucha energía rápidamente, como los propulsores para cohetes. Por ejemplo, reacciona con la glucosa de esta manera: <chem display="block">12 NaNO3 + C6H12O6 -> 12 NaNO2 + 6 CO2 + 6 H2O</chem>
Descomposición del Nitrato de Sodio
Cuando el nitrato de sodio se calienta a temperaturas entre 380 °C y 800 °C, se descompone en nitrito de sodio y oxígeno: <chem display="block">2 NaNO3(l) <=> 2 NaNO2(l) + O2(g)</chem>.
Si la temperatura supera los 800 °C, se forma óxido de sodio, nitrógeno y oxígeno: <chem display="block">4 NaNO3 -> 2 Na2O + 2 N2 + 5 O2</chem>
Usos del Nitrato de Sodio
El nitrato de sodio tiene muchas aplicaciones importantes:
- Se usa como fertilizante porque contiene nitrógeno, un nutriente esencial para las plantas.
- Mezclado con carbonato de sodio, se utiliza para obtener cromo de sus minerales.
- Es un aditivo para el cemento.
- Es un ingrediente principal en algunos tipos de mezclas para fuegos artificiales.
- Se ha usado para crear fuegos que arden bajo el agua, como el fuego griego.
- Ayuda a prevenir una enfermedad causada por bacterias llamada botulismo.
Nitrato de Sodio en la Agricultura
El nitrato de sodio es una fuente de nitrógeno que las plantas pueden usar de inmediato, ya que se disuelve fácilmente. Se ha usado como fertilizante desde mediados del siglo XIX. Es especialmente útil para cultivos como el tabaco.
En algunos programas de agricultura ecológica, el nitrato de sodio está permitido como un complemento para el nitrógeno. Esto es porque a veces las fuentes orgánicas de nitrógeno no liberan este nutriente lo suficientemente rápido para las plantas.
Nitrato de Sodio en Alimentos
El nitrato de sodio es un aditivo alimentario que se usa para conservar carnes y aves, y para mantener su color. Se le conoce como número INS 251 o número E E251. Su uso está aprobado en la Unión Europea, Estados Unidos, Australia y Nueva Zelanda. Es importante no confundirlo con el nitrito de sodio, que también es un aditivo común en carnes procesadas.
Uso para la Purificación de Oro
El nitrato de sodio se utiliza para recuperar oro de componentes electrónicos o de polvo de joyas. Puede usarse como un sustituto del ácido nítrico para preparar el "agua regia".
El agua regia es una mezcla de ácido nítrico y ácido clorhídrico que puede disolver el oro. El nitrato de sodio puede reemplazar al ácido nítrico en esta mezcla, lo que lo hace más fácil de usar para algunas personas.
El proceso para extraer oro con nitrato de sodio incluye neutralizar el ácido y luego hacer que el oro se separe en forma de pasta. Esta pasta se calienta para obtener el metal puro.
Preparación de Mezclas para Fuegos Artificiales
En la fabricación de algunas mezclas para fuegos artificiales, el nitrato de potasio o el nitrato de sodio se cubren con grafito (una forma de carbono). Esto ayuda a evitar que se acumule electricidad estática, lo que reduce el riesgo de que una chispa accidental encienda la mezcla antes de tiempo.
Efectos en la Salud del Nitrato de Sodio
El nitrato de sodio es una sustancia que debe manejarse con cuidado. Aunque en pequeñas cantidades no es muy dañino, puede transformarse en el cuerpo en nitrito, que tiene efectos más fuertes.
Algunos estudios han explorado cómo el consumo de nitratos podría estar relacionado con ciertos problemas de salud. Se ha investigado su posible conexión con la forma en que el cuerpo procesa los alimentos y cómo esto puede afectar las células. Es importante recordar que la dieta en general y el estilo de vida influyen mucho en la salud.
Las carnes procesadas que contienen nitrato y nitrito de sodio pueden formar compuestos que se han estudiado por su posible relación con cambios en las células del estómago y el intestino. Sin embargo, las plantas que comemos a diario también son una fuente importante de nitratos. Además, las carnes procesadas a menudo no tienen fibra, vitaminas ni antioxidantes, y pueden tener mucha sal o grasa. Una dieta equilibrada y rica en frutas, verduras y fibra es fundamental para la salud.
Véase también
 En inglés: Sodium nitrate Facts for Kids
En inglés: Sodium nitrate Facts for Kids




